电离度(弱电解质在水中电离程度的物理量)

VLoG
次浏览
更新时间:2023-05-19
电离度
弱电解质在水中电离程度的物理量
基本信息
| 中文名 | 电离度 |
| 外文名 | ionization degree |
| 表达式 | a=n(已电离的电解质)/n总 |
| 应用领域 | |
| 符号 | α |
定义和计算

弱电解质的电离






由上述公式可以看出:
当温度与浓度一定时,对于不同的弱电解质,Ka或Kь越大,则α越大,溶液酸性(对于一元弱酸)或碱性(对于一元弱碱)越强。
当温度一定时,对于同一弱电解质来说,浓度越小,则α越大,但溶液酸性(对于一元弱酸)或碱性(对于一元弱碱)越弱。
多元弱酸、弱碱的电离是分步进行的,每步电离都存在相应的电离平衡。实验和理论计算证明,它们的二步电离度远远小于一步电离度,三步电离度又远远小于二步电离度。所以,多元弱酸溶液的氢离子浓度,多元弱碱溶液的氢氧根离子浓度,均可以近似以一步电离的离子浓度代替。
因此,在表示弱电解质的电离度时,必须指明溶液的浓度和温度。
n:带电离子数目;
N:气体质点总数目。
影响因素
引起电离的原因很多。例如,气体粒子受电子或离子的撞击或受电磁波(光、X 射线等)的辐照,固体表面受电子或离子轰击,固体受到高热等,都有可能产生电离现象。
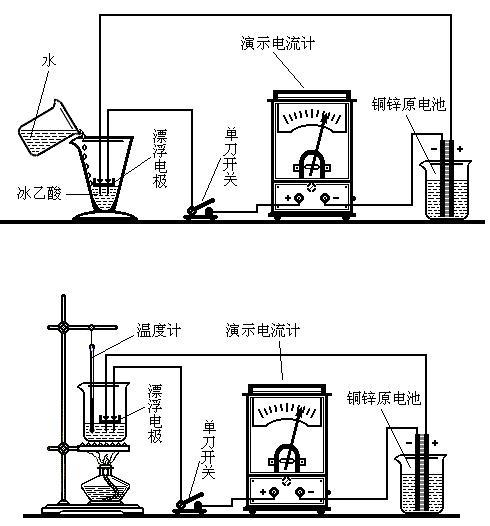
温度和浓度对电离度影响的实验探讨
电离常数









