四氧化三铁(混合价态铁氧化物)

VLoG
次浏览
更新时间:2023-05-19
四氧化三铁
混合价态铁氧化物
基本信息
中文名
四氧化三铁
英文名
Triiron tetraoxide
别名
铁黑、磁性氧化铁
拼音
sì yǎng huà sān tiě
CAS编号
1317-61-9
化学式
Fe₃O₄
相对分子质量
231.54
物理性质
外观
黑色立方系结晶或无定形粉末
熔点
1594 ℃(分解)
密度
5.17 g/cm³[22]
水溶性
不溶于水碱及乙醇、乙醚等有机溶剂
发现历史
天然磁石的主要成分是四氧化三铁,公元前6-7世纪,中西方都各自发现了天然磁石吸铁现象,中国人由此发明了司南、指南针并应用于航海,影响了人类文明的发展。人类最早对四氧化三铁的理解开始于19世纪早期,化学分析表明这种磁性材料的分子组成为Fe₃O₄。最早布拉格(Bragg)称四氧化三铁具有立方尖晶石结构,后来韦尔维(Verwey)和布尔(Boer)经过分析,认为四氧化三铁有反尖晶石结构。1948年,尼尔(Neel)推进了亚铁磁性理论。1984年,Yanase和Siratori通过能带结构计算研究,发现具有立方尖晶石结构的四氧化三铁是稀少的具有多数自旋方向带隙的半金属铁磁体。2002年,Mortonx通过自旋极化光发射谱法测量了四氧化三铁的自旋极化率为-40%,四氧化三铁的电运输特性被人们广泛研究。
分布情况
物质结构
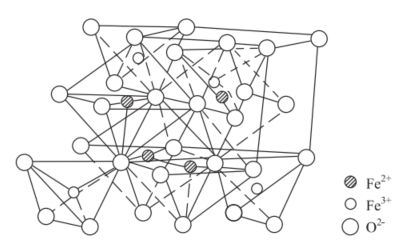
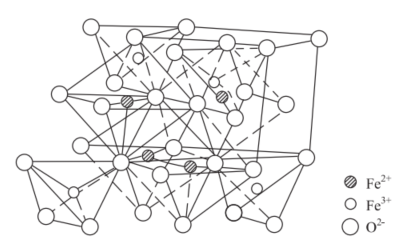
四氧化三铁是Fe²⁺、Fe³⁺、O²⁻组成的反尖晶石结构离子晶体,晶体由O²⁻组成含四面体空隙和八面体空隙的骨架,Fe²⁺、Fe³⁺填充在O²⁻形成的多面体空隙中。具体结构如图下所示:
理化性质
物理性质
化学性质
四氧化三铁不与碱反应,溶于浓酸、热强酸,能够被强还原剂还原或被强氧化剂氧化。
与酸反应
四氧化三铁能与盐酸、硫化氢发生以下反应:


氧化还原反应






四氧化三铁能被氧气氧化成三氧化二铁,被重铬酸钾的酸性溶液氧化成三价铁盐。


制备方法
湿法
直接合成法


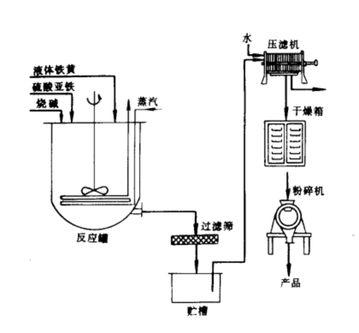
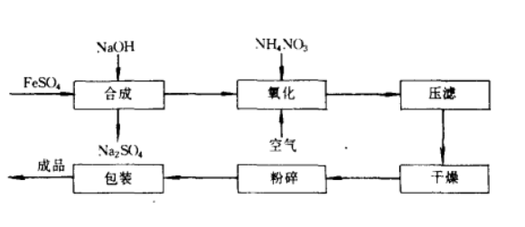
氢氧化亚铁氧化法
氢氧化亚铁氧化法的做法是在一定的pH和温度下,将氢氧化钠溶液和硫酸亚铁溶液混合反应生成氢氧化亚铁溶液。

氢氧化亚铁不稳定,随着反应的进行,在搅拌的作用下氧化亚铁会被空气氧化成绿锈,反应接近终点时,投入适量氧化剂硝酸铵并鼓入空气。


生成的铁黑沉淀经分离、干燥、粉碎即可获得四氧化三铁产品。
干法
干法制备四氧化三铁的做法是将粉碎后的三氧化二铁在严格控制的反应条件下还原成四氧化三铁。
纳米材料制备

溶胶-凝胶法:做法是按比例将

溶剂热法:采用醇、胺、酮等作为溶剂,溶剂能够溶解反应物为反应提供液相环境同时也充当还原剂将三价铁还原成二价铁;加入的矿化剂使的反应能够进行,并且通过调整矿化剂能够改变四氧化三铁粒子的大小;调整表面活性剂的种类和浓度能够影响四氧化三铁粒子的形状。
应用领域
环境领域
四氧化三铁的磁性纳米粒子比表面积极高,因此具有很好的吸附性能,在水处理,例如去除水中的重金属离子等方面有巨大优势;有磁性,在磁场的作用下能够从溶剂中快速分离并避免二次污染;有易修饰功能团,能对目标物产生特异性亲和吸附的效果。不过四氧化三铁磁性纳米颗粒也有其局限性,如裸露在空气中的四氧化三铁纳米颗粒极易氧化,容易因磁性发生团聚导致吸附性能下降等,所以需要对四氧化三铁纳米颗粒进行改性和修饰,以提升器对重金属离子的吸附效果。
生物医学领域
四氧化三铁有优异的生物相容性、低毒性,在医学领域可用于磁性靶向给药、生物标定、细胞标记、核磁造影等。比如在肿瘤治疗中,四氧化三铁纳米粒子能够增强肿瘤的核磁共振成像信号、用于热磁治疗、负载药物将药物输送至指定位置等。
材料领域
四氧化三铁具有特殊的光电磁效应,能够用于制作新型电子材料和特殊功能性材料,如制备磁性流体,磁性液体是含有众多纳米级的铁磁性或亚铁磁性微粒并且性质稳定的胶体溶液,是既有液体的流动力,又有固体的磁性的一种新型功能材料。这种磁性液体即便受到外界磁场、重力场等的作用也能长期稳定存在,被广泛应用于印刷、真空密封包装、传感器等领域中。
催化领域
四氧化三铁粒子具有巨大的比表面积,能够作为催化剂,例如催化有机合成反应、催化降解有机染料等,且因为其自身具有磁性,相较其他催化剂具有能够快速分离回收的优点;四氧化三铁纳米粒子还能充当催化剂的载体,方便催化剂的回收利用等,比如负载贵金属催化剂、有机化合物催化剂。
能源领域
储氢:

放氢:










