大π键(3个或3个以上原子形成的π键)

VLoG
次浏览
更新时间:2023-05-19
大π键
3个或3个以上原子形成的π键
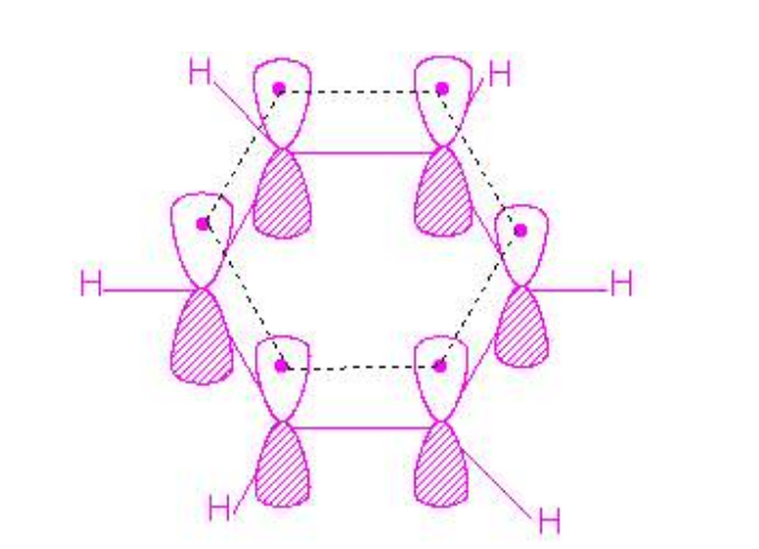
形成条件
①这些原子多数处于同一平面上;
②这些原子有相互平行的p轨道;
③p轨道上的电子总数小于p轨道数的2倍。
大π键
例如,苯的分子结构是六个碳原子都以 杂化轨道结合成一个处于同一平面的正六边形,每个碳原子上余下的未参加杂化的p轨道,由于都处于垂直于苯分子形成的平面而平行,因此所有p轨道之间,都可以相互重叠而形成以下图式:
杂化轨道结合成一个处于同一平面的正六边形,每个碳原子上余下的未参加杂化的p轨道,由于都处于垂直于苯分子形成的平面而平行,因此所有p轨道之间,都可以相互重叠而形成以下图式:

苯的大π键是平均分布在六个碳原子上,所以苯分子中每个碳碳键的键长和键能是相等的。
又如,1,3-丁二烯分子式为 。4个碳原子均与3个原子相邻,故采用
。4个碳原子均与3个原子相邻,故采用 杂化。这些杂化轨道相互重叠,形成分子σ骨架,故所有原子处于同一平面。每个碳原子还有一个未参与杂化的p轨道,垂直于分子平面,每个p轨道里面有一个电子,故丁二烯分子中存在一个“4轨道4电子”的p-p大π键。通常用
杂化。这些杂化轨道相互重叠,形成分子σ骨架,故所有原子处于同一平面。每个碳原子还有一个未参与杂化的p轨道,垂直于分子平面,每个p轨道里面有一个电子,故丁二烯分子中存在一个“4轨道4电子”的p-p大π键。通常用 来表示,其中a为平行的p轨道的数目,b表示平行p轨道里电子数。
来表示,其中a为平行的p轨道的数目,b表示平行p轨道里电子数。








