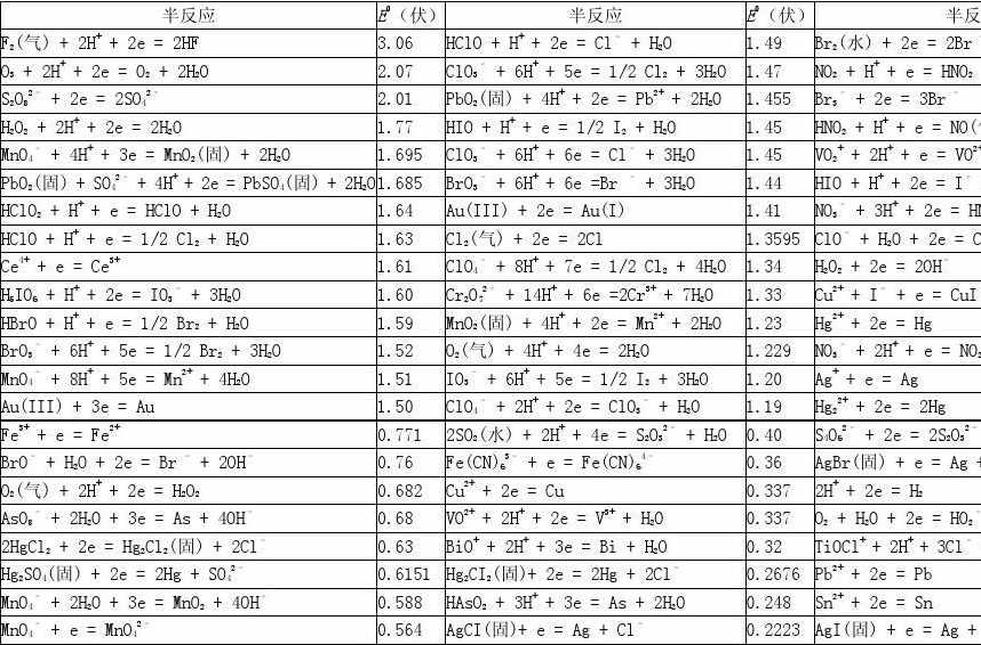
标准电极电位(以氢原子作为参比电极的电势)

VLoG
次浏览
更新时间:2023-05-20
概况
概念
相关问题
为了能正确使用标准电极电位表(课本或化学手册上均有较详细的表),现将有关的一些问题叙述如下:
(1)在 电极反应中,M叫做物质的还原态。
电极反应中,M叫做物质的还原态。 叫做物质的氧化态,物质的还原态和氧化态构成氧化还原电对。电对也常用符号来表示,例如
叫做物质的氧化态,物质的还原态和氧化态构成氧化还原电对。电对也常用符号来表示,例如 是一个电对,
是一个电对, 也是一个电对等。
也是一个电对等。




(2)在表中所列的标准电极电位的正、负数值,因电极反应进行的方向而改变。例如,当电极反应按 ,或者按
,或者按 的方式进行时,电对(
的方式进行时,电对( )的标准电极电位符号是相反的。
)的标准电极电位符号是相反的。



(3)在表中,物质的还原态的还原能力自下而上依次增强;物质的氧化态的氧化能力自上而下依次增强。具体地说,电对的电极电位数值越小,在表中的位置越高,物质的还原态的还原能力越强,电对的电极电位数值越大,在表中的位置越低,物质的氧化态的氧化能力越强。例如电对 的标准电极电位的数值为-0.76伏较Cu数值+0.34伏为小,所以Zn原子较Cu原子容易失去电子,即Zn是较强的还原剂。
的标准电极电位的数值为-0.76伏较Cu数值+0.34伏为小,所以Zn原子较Cu原子容易失去电子,即Zn是较强的还原剂。

(4)物质的还原态的还原能力越强,其对应的氧化态的氧化能力就越弱,标准电极电位越小;物质氧化态的氧化能力越强,其对应的还原态的还原能力就越弱,标准电极电位越大。例如表7—2中K是最强的还原剂,其对应的K+离子则是最弱的氧化剂,F2是最强的氧化剂,其对应的F则是最弱的还原剂。