电子亲和能(衡量原子核与电子吸引力的指标)

VLoG
次浏览
更新时间:2023-05-22
电子亲和能
衡量原子核与电子吸引力的指标
基本信息
| 外文名 | electronic affinity |
| 应用学科 | |
| 定义 | 指真空的自由电子能级与导带底能级之间的能量差。 |
化学术语
定义气态原子(基态)获得一电子成为-1价气态离子时所放出的能量,叫做电子亲和能。原子的电子亲和能是指在 下的气相中,原子和电子反应生成负离子时所释放的能量。(Electron Affinities of Atoms)一个基态气态原子得到一个电子形成气态负一价离子所放出的能量称为第一电子亲和能,以EA1表示,依次也有EA2、EA3等等。
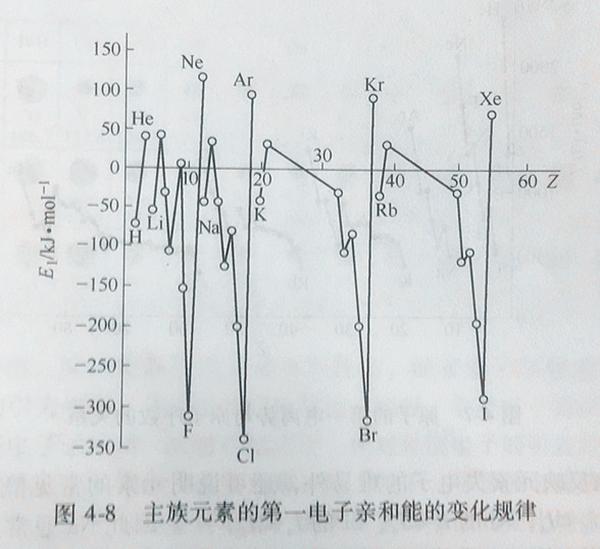
下的气相中,原子和电子反应生成负离子时所释放的能量。(Electron Affinities of Atoms)一个基态气态原子得到一个电子形成气态负一价离子所放出的能量称为第一电子亲和能,以EA1表示,依次也有EA2、EA3等等。 元素的第一电子亲和能越大,表示元素由气态原子得到电子生成负离子的倾向越大,该金属非金属性越强。影响电子亲和能大小的因素与电离能相同,即原子半径、有效核电荷和原子的电子构型。它的变化趋势与电离能相似,具有大的电离能的元素一般电子亲和能也很大。电子亲和能:对于原子而言,一个中性原子获得一个电子而成为负离子时所放出的能量,就是原子的亲和能。定义:用反应式表示:(g):(气态)7族元素的第一电子亲和能F
元素的第一电子亲和能越大,表示元素由气态原子得到电子生成负离子的倾向越大,该金属非金属性越强。影响电子亲和能大小的因素与电离能相同,即原子半径、有效核电荷和原子的电子构型。它的变化趋势与电离能相似,具有大的电离能的元素一般电子亲和能也很大。电子亲和能:对于原子而言,一个中性原子获得一个电子而成为负离子时所放出的能量,就是原子的亲和能。定义:用反应式表示:(g):(气态)7族元素的第一电子亲和能F










规律性能
氟为何没有遵守规律
与族内其它元素比较,氟的外来电子是离原子核最近的。因此按我们前面所考虑到的因素来说,氟的电子亲和能应该是最高的。
但,由于氟是很小的原子,在氟原子所占据的不大的空间中挤满了电子,这些拥挤在一起的电子对外来电子产生异常强烈的排斥作用。这种排斥作用削弱了原子核对外来电子的吸引力,电子亲和能随之减少。
元素亲和能数据
以下为元素的电子亲和能数据,仅作参考
。
氢 | 72.77 |
锂 | 59.62 |
硼 | 26.99 |
碳 | 121.78 |
氧 | 141.004 |
展开表格



