氧化还原电极(发生电子迁移现象的化学反应)

VLoG
次浏览
更新时间:2023-05-22
氧化还原电极
发生电子迁移现象的化学反应
概述
名称:氧化还原电极,redox eleCtrode
通过电子迁越金属和溶液相界面来完成反应的电极。如铂丝浸在含Fe 、Fe 的水溶液中所构成的电极。电极反应在同一溶液中的两种物制质间进行( ),金属只起提供或接受电子的作用,不直接参与反应。电极电势与两种离子的浓度有关。
),金属只起提供或接受电子的作用,不直接参与反应。电极电势与两种离子的浓度有关。

氧化还原与原电池
将Zn片插入到 溶液中,会立即自发进行下述反应:
溶液中,会立即自发进行下述反应:


反应式


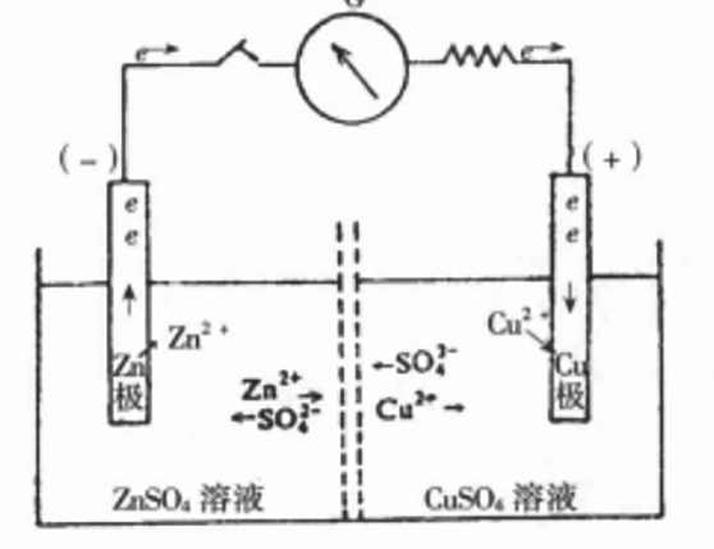
根据电学原理,若能利用一种装置,将氧化还原反应中的电子转移变成一种有序的电子流动,即不让电子直接转移,而是使还原剂失去的电子通过导线转移到氧化剂上,就可获得电能。丹尼尔电池就是实现这一设想的装置。在丹尼尔电池中,左边为插有一块Zn片的 溶液,右边为插有一块Cu片的
溶液,右边为插有一块Cu片的 溶液。两溶液用一种可让离子自由通过的多孔隔膜隔开。当Zn片和Cu片用一串有检流计的导线相连时,检流计的指针发生偏转,证明导线中有电流通过。
溶液。两溶液用一种可让离子自由通过的多孔隔膜隔开。当Zn片和Cu片用一串有检流计的导线相连时,检流计的指针发生偏转,证明导线中有电流通过。


这种利用氧化还原反应,将化学能转变为电能的装置,称为原电池,简称电池。
原电池中规定,电子流出的一极为负极,电子流入的一极为正极。在 原电池中,电子从Zn片流向Cu片,Zn片一端为负极,Cu片一端为正极。
原电池中,电子从Zn片流向Cu片,Zn片一端为负极,Cu片一端为正极。 溶液中的Cu 从Cu片上得到电子,还原为Cu沉积在Cu片上,Zn失去电子变为Zn 进人ZnSO溶液中。两个电极上的
溶液中的Cu 从Cu片上得到电子,还原为Cu沉积在Cu片上,Zn失去电子变为Zn 进人ZnSO溶液中。两个电极上的


反应分别为:
正极: (还原反应)
(还原反应)

将两个电极反应式相加,得电池反应式: 。
。

因为锌(或铜)电极只是组成原电池的一半,故每个电极也称半电池。每个电极上所发生的氧化(或还原)反应称半电池反应或半反应。每个半反应都是由同一元素的两种不同氧化数的物质组成,其中氧化数高的称为氧化型,氧化数低的称还原型,它们构成氧化还原电对,简称电对。用符号表示成氧化型/还原型。如电对Zn /Zn、Cu /Cu。
理论上,任何一个自发进行的氧化还原反应都可以设计成原电池。由于氧化还原反应中,氧化剂得电子发生还原反应,还原剂失电子发生氧化反应,因此构成原电池时,氧化剂及其还原产物构成的电对为正极,还原剂及其氧化产物构成的电对为负极。
在 原电池中,随着电池反应的进行,ZnSO溶液中Zn 不断增多,使溶液带正电,异极相吸使Zn难以失去电子,阻止Zn进一步氧化。与此同时,CuSO溶液由于Cu 变为Cu沉积在Cu片上,使溶液中SO 过量带负电荷,同性相斥阻止电子流向Cu片,妨碍了Cu 的进一步还原。两边溶液均带电荷,势必会阻碍电池反应的继续进行。但两溶液间的多孔隔膜允许离子通过,左侧溶液中过剩的Zn 向右侧溶液扩散;右侧溶液中过剩的SO 向左侧扩散,维持两边溶液的电中性,使电池反应持续进行。由于Zn 和SO 扩散通过两溶液的接触界面的速度有差异,在两溶液的接触界面上会产生一种电势差,称为液接电势,它的存在会影响电池电动势的准确测定。为消除液接电势,常采用盐桥取代多孔隔膜。
原电池中,随着电池反应的进行,ZnSO溶液中Zn 不断增多,使溶液带正电,异极相吸使Zn难以失去电子,阻止Zn进一步氧化。与此同时,CuSO溶液由于Cu 变为Cu沉积在Cu片上,使溶液中SO 过量带负电荷,同性相斥阻止电子流向Cu片,妨碍了Cu 的进一步还原。两边溶液均带电荷,势必会阻碍电池反应的继续进行。但两溶液间的多孔隔膜允许离子通过,左侧溶液中过剩的Zn 向右侧溶液扩散;右侧溶液中过剩的SO 向左侧扩散,维持两边溶液的电中性,使电池反应持续进行。由于Zn 和SO 扩散通过两溶液的接触界面的速度有差异,在两溶液的接触界面上会产生一种电势差,称为液接电势,它的存在会影响电池电动势的准确测定。为消除液接电势,常采用盐桥取代多孔隔膜。


盐桥原电池





