普鲁士蓝(一种聚合络合物由C、N、Fe三种元素组成)

VLoG
次浏览
更新时间:2023-05-23
普鲁士蓝
一种聚合络合物由C、N、Fe三种元素组成

基本信息
中文名
普鲁士蓝
英文名
Prussian Blue
别名
亚铁氰化铁、滕氏蓝
拼音
PuLuShiLan
CAS编号
14038-43-8
性质
化学式
Fe₄[Fe(CN)₆]₃
摩尔质量
859.23 g/mol
外观
深蓝色粉末
密度
1.8 g/cm³
溶解性
不溶于水
研究历史
早在18世纪,柏林的颜料制造商和钾盐卖家兼炼金术士便发现了普鲁士蓝,他们是在在制作胭脂红时,通过观察其中的沉淀的才偶然发现了亚铁氰化铁(普鲁士蓝),Fe₄[Fe(CN)₆]₃,后称作普鲁士蓝)。1814年,首次通过电解Na₄[Fe(CN)₆]获得了普鲁士蓝。
结构特点
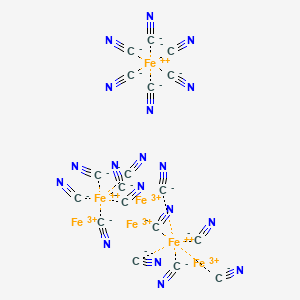
1936年提出了第一个关于普鲁士蓝立体结构模型, 当时认为普鲁士蓝是一种简单的 NaCl 类似物,Fe(III) 和 Fe(II) 离子位于面心立方晶格节点中,然而该模型并未指出C、N原子所在的位置。1939年提出了普鲁士蓝的另一结构模型,该结构模型虽然确定了CN 离子位于晶格边缘的桥接位置,但仍未确定过量Fe(III)离子所在的位置。 直到1977年,通过单晶电子和中子衍射技术精确测量了普鲁士蓝的详细结构信息,确定了过量Fe(III)离子位于间隙位置,才正式确定普鲁士蓝的晶体结构。
理化性质
物理性质
普鲁士蓝一般为深蓝色,是一种聚合络合物,由C、N、Fe三种元素组成,一般指亚铁氰化铁,其分子式为Fe₄[Fe(CN)₆]₃,密度为1.8 g/cm³,沸点为25.7 ℃,其不溶于水,微溶于大多数有机溶剂。
化学性质
普鲁士蓝易溶于酸、碱,可形成胶体。其在加热时会分解,可以释放出有毒的氰化氢和氨气。
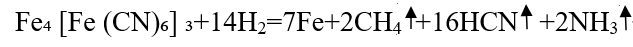
在实验室中,普鲁士蓝的生成反应还可以用来检测CN⁻:
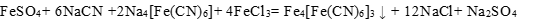
制备方法
亚铁氰化盐发生氧化反应也可直接获得普鲁士蓝。
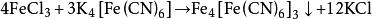
纳米级普鲁士蓝常采用电化学沉积法制备,即将电极放入含有三价铁离子和K₃Fe(CN)₆的电解液中,三价铁离子在电极的作用下会得到电子被还原为亚铁离子,亚铁离子进而和K₃Fe(CN)₆发生反应制得纳米级普鲁士蓝。
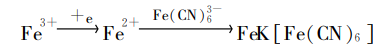
应用领域
颜料
普鲁士蓝最开始被用作绘画的颜料。其还在彩绘泥塑方面也有应用。并由此衍生出一种工艺——蓝晒工艺。
医疗领域
普鲁士蓝在医疗领域也具有很广泛的应用,医学上对于铁血黄素的传统染色方法便是对于普鲁士蓝的很好利用,主要是由盐酸和普鲁士蓝在不同配比下形成不同浓度的染液,继而分别对病理切片进行染色处理,通过观察其颜色变化来判断铁血黄素的含量。
普鲁士蓝的另一应用便是作为一种纳米材料,普鲁士蓝纳米材料具有很高的化学稳定性和生物安全性,所以常被用作靶向药物的基础材料,并且普鲁士蓝所包含的铁离子和亚铁离子可以互相转换,利用这一特点普鲁士蓝也可以应用于成像处理。
分析化学
普鲁士蓝还可用来检测患者扁桃酸水平,之前便有报道一种用羟肟酸铁比色法快速检测扁桃酸的方法,这种检测方法虽然快捷,但制备过程中涉及到对皮肤有刺激性且剧毒的盐酸羟胺。而通过比色法使用普鲁士蓝进行检测便没有上述问题,并且操作简单,通过测定不同波长条件下的吸光度,进而的到相应吸光度条件下的线性回归方程。
通过分光光度法,普鲁士蓝还可以用来检测蔬菜中的维生素C的含量,因为维C本身便具有还原性,可以将普鲁士蓝中的三价铁离子还原为二价铁离子,而二价铁离子可以和与K3[Fe(CN)6]反应生成可溶性普鲁士蓝,通过测定普鲁士蓝在特定波长的吸光度变化便可以推算出维C含量。
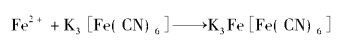
化工领域
普鲁士蓝本身具有很好的稳定性,可以通过化学方法将制备好的普鲁士蓝用于对电极的修饰,一种对称型可变色超级电容器便是应用普鲁士蓝作为电极修饰材料的应用,氧化钨薄膜和普鲁士蓝薄膜具有电极变色作用,利用在不同离子变化状态下两种材料的变色互补性,进行可变色超级电容器的构筑,进而利用脉冲激光沉积法制备包含两种材料的复合薄膜,通过将这种复合薄膜做为电极,制作出一种对称型可变色超级电容器。
普鲁士蓝所具有的立体结构和原子特点,使其具备了一定的催化性和氧化还原性,而石墨烯材料虽然具有良好的导电性,但其没有特定的化学功能,所以可以将普鲁士蓝纳米材料和石墨烯材料通过真空抽滤而制作一种普鲁士蓝-氧化石墨烯复合薄膜,使得他们的特点得到综合和加强。
环境领域
安全事宜
导致小鼠、大鼠和兔急性毒性的口服剂量为 >8000mg/kg。其表现症状包括顽固性便秘、梗阻或电解质严重减少。
储存及保藏
贮存地应保持通风和干燥,不可与碱性物质共存、防高温。


