实际溶液(实际溶液)


实际溶液是实际存在的溶液,实际溶液的溶剂不遵守拉乌尔定律,溶质也不遵守亨利定律。
真实溶液
实际存在的溶液
研究背景
溶液根据其所表现出来的特征分为三大类:
(1)理想溶液:其在定温定压下溶液中所有物质在全部浓度范围内均遵守拉乌尔定律;
(2)稀溶液:其在较稀的浓度范围内溶剂遵守拉乌尔定律,溶质遵守亨利定律;
(3)实际溶液:溶剂不遵守拉乌尔定律,溶质也不遵守亨利定律。[1]
计算方法
对于冶金反应的热力学分析,最重要的是计算反应标准自由焓和平衡常数。对于纯物质反应来说,这一问题已经基本解决了,但对于有溶液参加的冶金反应,还未涉及。这类有溶液参加的冶金反应,其热力学分析的重点仍是计算它们的标准自由焓。若参与反应的溶液是符合亨利定律和拉乌尔定律的理想溶液,计算起来也是方便的,只需利用溶液中参与反应物质的化学位,问题不难解决。但很遗憾的是实际溶液中各组元并不遵守拉乌尔定律和亨利定律,它们的化学位就不可能写成像理想溶液各组元化学位那样简明的浓度显函数形式。因此,在涉及实际溶液稳得化学平衡时,平衡常数就不能简单地用平衡浓度商来表示。解决这个问题有两个可供选择的途径:
(1)把已知的现象概括起来,重新研究高温溶液,发现新定律,但这样做很困难;
(2)仍采用适用于理想溶液的定律,但采取溶液中组元的“有效浓度”来代替拉乌尔定律和亨利定律中的实际(表观)浓度,也就是用一个因数来校正溶液中组元的实际浓度,使之适合于理想溶液的定律。这是通常采用的措施。这个校正因数称活度系数,而“有效浓度”称为活动。这样,实际溶液中各组元也就有了类似于理想溶液中各组元化学位那样的简明的以活度显函数形式表示的化学位。有了它,计算有溶液参加的冶金反应的标准自由焓和平衡常数,就十分方便了。
这样一来,在计算有溶液参加的化学反应的标准自由焓时,首先要解决溶液中组元的活度问题。由此可见,活度是人们创造的概念,它是解决带实际性理论问题的简单工具,虽然它解决不了物理化学现象的本质,但它能从实际角度出发,解决实际问题。
活度
由于所引用的电解质溶液浓度标度不同,而得出不同的活度系数,如浓度的标度为C(体积摩尔浓度);X(摩尔分数);m(质量摩尔浓度),则溶液的活度系数就分别为y、f、和v。

实际溶液
所以对于不同浓度标度的实际溶液活度系数之间的相互关系为:式中ρ、ρ分别为溶剂和溶液的密度;M、M分别为溶剂和溶液的分子量。
其中,Y、v为“实用”活度系数;f为“合理”活度系数。[1]
实际溶液的偏差
实际溶液大多数都对拉乌尔定律呈现或大或小的偏差。若溶液中某组元的实测蒸气压大于按乌拉尔定律的计算值,则成为正偏差;反之,为负偏差。
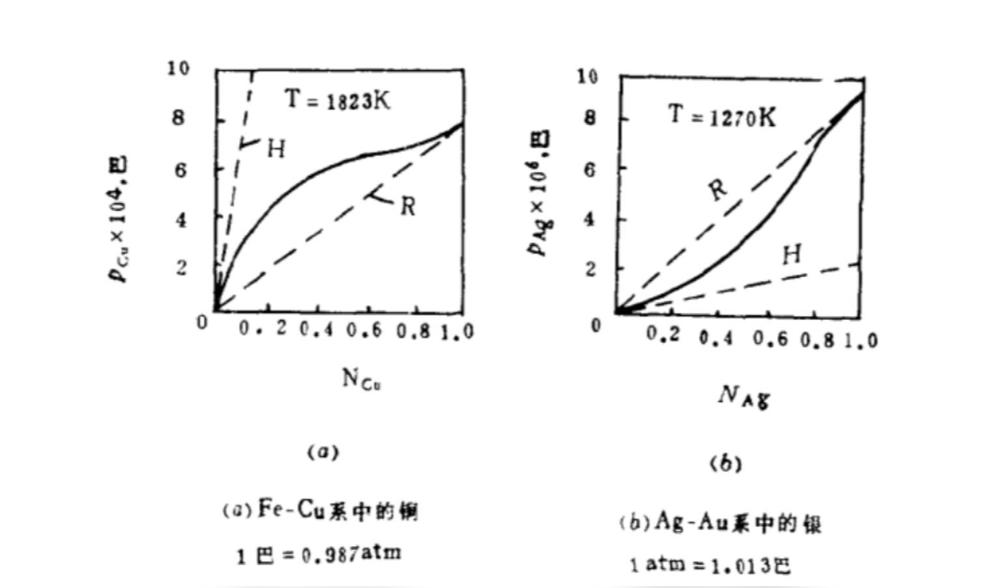
正偏差如果组元在溶液上方的实测蒸气压大于按乌拉尔定律的计算的饱和蒸气压,则偏差被认为是正偏差。如图a中所描绘的Fe-Cu系中铜的蒸气压。
蒸气压高于理论值,说明溶液中两类分子A-B(此处为Fe-Cu)间相互作用力小于同类分子B-B间的吸引力(此处为Cu-Cu),则当把A分子渗入到B分子时,必然减少B分子所受到的吸引力,B变得易于自液体中逸出,所以B组元的蒸气分压产生正偏差。由于同名质点(同类分子)相互作用力大于异名质点(两类分子),而相互作用力大者有聚集倾向。因此正偏差的极端情况是液相分层。第二种可能产生正偏差的情况是,若组元A原包含于缔合分子中,在形成溶液后发生解离(或缔合度减小),使溶液中A分子数目增加,A的蒸气分压增大,也会产生正偏差。
当形成正偏差时,体积增大,并有吸热现象。
正偏差与负偏差
负偏差如果组元在溶液上方的实测蒸气压小于按乌拉尔定律的计算的饱和蒸气压,则偏差被认为是负偏差。如图b中所描绘的Ag-Au系中银的蒸气压。
蒸气压低于理论值,这就表明两类分子间的相互作用力大于同类分子,阻碍了溶液中同类分子的蒸发。这种溶液的一个极端情况是组成溶液的两组元有可能生成化合物。
当这种溶液形成时,体积收缩并有放热现象。
1.实际溶液—电解质溶液的活度及活度系数 · 知网(引用日期:2018-01-26)


