超二级结构(M.Rossmann提出的概念)

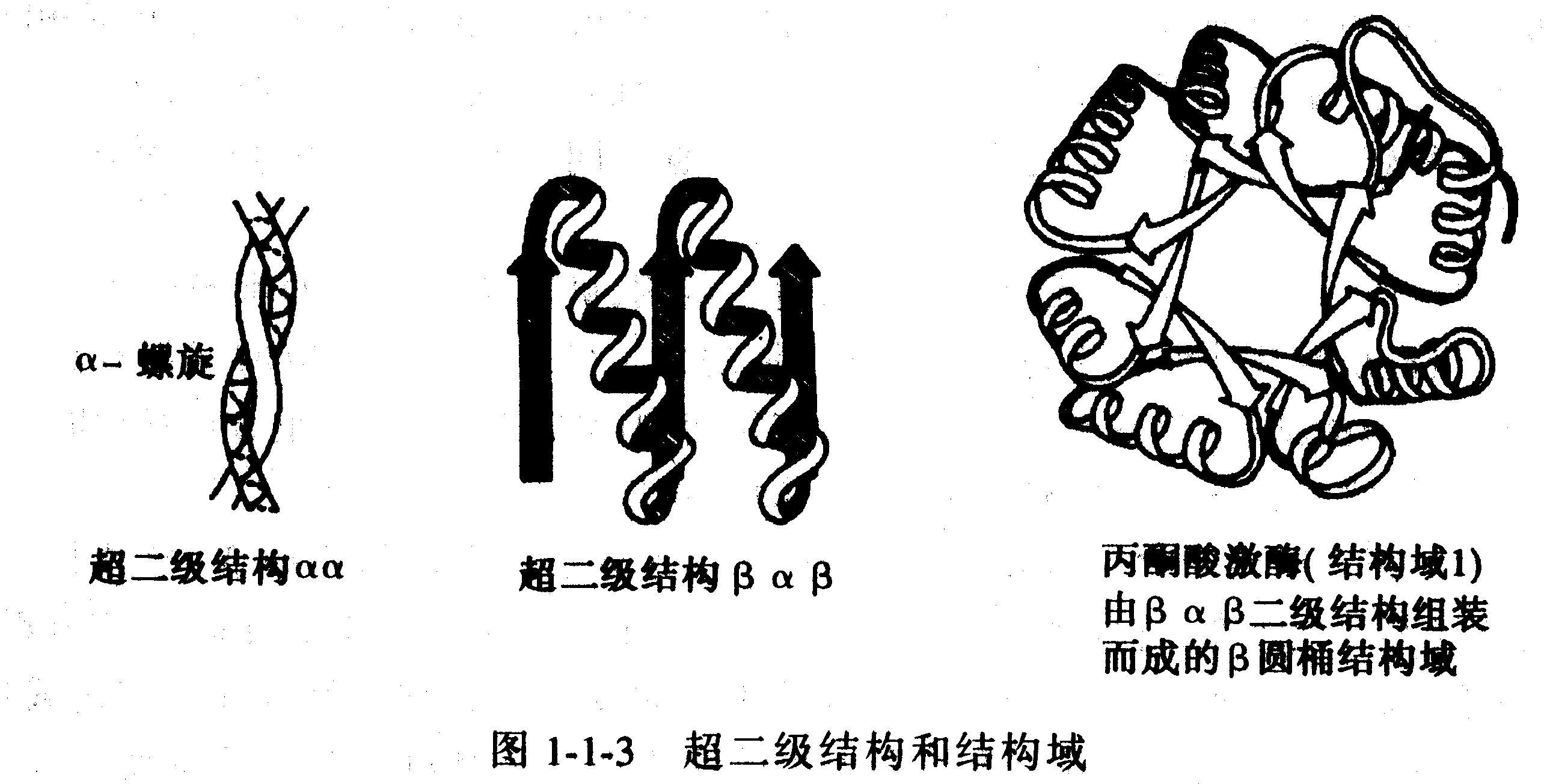
超二级结构的概念是M.Rossmann于1973年提出来的。超二级结构是指蛋白质分子中特别是球状蛋白质分子中,由若干相邻的二级结构单(主要是一a螺旋 和b -折叠)彼此相互作用,形成种类不多、有规则的几何组合。超二级结构在多种蛋白质中充当三级结构的构件。
超二级结构
supersecondary structure
M.Rossmann
1973年
组合单元
αα组合形式
若干二级结构可以特殊的几何组合出现在蛋白质结构中,这些组合起来的结构单元称作超二级结构或花样。超二级结构可与某些特殊的生物功能相联系,也可仅作为结构的组装块。α-环-α花样是含有两个α-螺旋,并以一个环区域相连接的具有特殊功能的超二级结构。在已知的蛋白质结构中观察到两种这样的花样,一种是 DNA结合花样,另一种是钙结合花样又称EF手,每种都有自己的几何形状和所需的氨基酸残基序列。
EF手出现在来自肌肉的蛋白Parvalbumin,troponin以及calmodulin等结构中,它们通过结合钙来调节细胞功能的变化。EF手提供了一个维持钙配基的支架用于结合和释放钙,这是人们在蛋白质结构中首先认识的功能花样之一。
ββ组合形式
发夹β或β-环-β花样是两条反平行的β-链,通过一个环相连接构成的超二级结构,在蛋白质结构中频繁出现。Β-回折中相邻近的两条β链易形成这种发夹β 花样。两条β链之间的环的长度不等,一般为2-5个残基。与α-环-α花样不同的是,发夹β花样无特殊的功能。
希腊图案花样
四个邻近的反平行β-链通常被排列为类似于古希腊装饰图案,因此被称作希腊图案花样,常见于蛋白质结构中,但与特殊功能无直接关联。
βαβ组合形式
发夹花样通常用来连接两条反平行的β-链。如何连接两条平行的β-链?如果两条相邻块平行β-链的残基顺序是连续的,其连接部分必须处于β-回折的两端。多肽链必须依靠环区域转两次才能够使这两条链平行,依次为:β链-环1-α螺旋-环2-β链,这样的花样称为β-α-β花样。此花样在具有平行β-回折的每一种蛋白质结构中均存在。在这样的结构中,与β-链的羧基端和α-螺旋的氨基端相连的环1常含有功能性结合部位或活性部位,而另一个与β-链的氨基端和 α-螺旋的竣基端相连的环2则尚未发现与活性部位有关。这种β-α-β花样可以认为是一个松散的螺旋圈,在已知的蛋白质结构中,基本上每一个β-α-β花样都是右手α-螺旋,因此被称作"右手"花样,对此尚无满意的解释。
βαβαβ组合形式
又称罗斯曼折叠模式,是一种由两个重复的部分组成,每个部分包括6个平行的β折叠与两对α螺旋形成β-α-β-α-β的拓扑结构的蛋白质结构基序,常见于核苷酸结合蛋白质,特别是辅因子NAD结合蛋白。
与结构域区别
超二级结构(supersecondary structure)是指在多肽链内顺序上相互邻近的二级结构常常在空间折叠中靠近,彼此相互作用,形成规则的二级结构聚集体。目前发现的超二级结构有三种基本形式:α螺旋组合(αα);β折叠组合(βββ)和α螺旋β折叠组合(βαβ),其中以βαβ组合最为常见。它们可直接作为三级结构的“建筑块”或结构域的组成单位,是蛋白质构象中二级结构与三级结构之间的一个层次,故称超二级结构。
结构域(domain)也是蛋白质构象中二级结构与三级结构之间的一个层次。在较大的蛋白质分子中,由于多肽链上相邻的超二级结构紧密联系,形成二个或多个在空间上可以明显区别它与蛋白质亚基结构的区别。一般每个结构域约由100-200个氨基酸残基组成,各有独特的空间构象,并承担不同的生物学功能。如免疫球蛋白(IgG)由12个结构域组成,其中两个轻链上各有2个,两个重链上各有4个;补体结合部位与抗原结合部位处于不同的结构域。一个蛋白质分子中的几个结构域有的相同,有的不同;而不同蛋白质分子之间肽链中的各结构域也可以相同。如乳酸脱氢酶、3-磷酸甘油醛脱氢酶、苹果酸脱氢酶等均属以NAD+为辅酶的脱氢酶类,它们各自由2个不同的结构域组成,但它们与NAD+结合的结构域构象则基本相同。
名词解释
超二级结构:二级结构单元a-螺旋和β-折叠,相互聚集形成有规律的更高一级的但又低于三级结构的结构


