网格蛋白(网格蛋白)

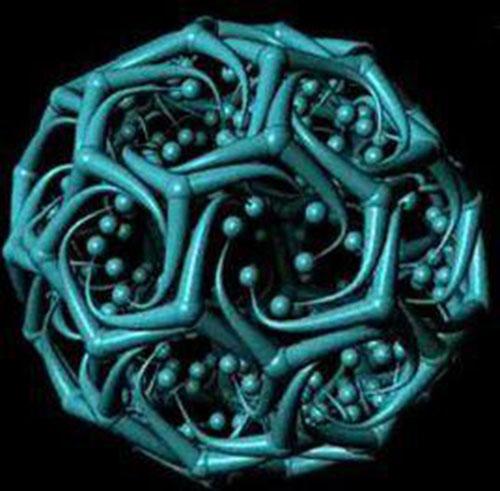
网格蛋白(clathrin)是一种进化上高度保守的蛋白质,由分子量为180kDa的重链和分子量为35~ 40kDa的轻链组成二聚体,三个二聚体形成包被的基本结构单位——三联体骨架(triskelion),称为三腿蛋白(three-legged protein)。
clathrin
三腿蛋白
结构
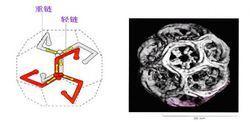
网格蛋白示意图
有两种类型的轻链:α链和β链,二者的氨基酸有60%是相同的,但还不知道它们在功能上有什么差别。许多三腿复合物再组装成六边形或五边形网格结构,即包被亚基,然后由这些网格蛋白亚基组装成披网格蛋白小泡。功能
运输作用
网格蛋白在人体中起运输的作用,生物分子激素、神经递质、膜蛋白等物质都可通过网格蛋白进行运输。
在内吞过程中,质膜上受体与配体特异结合部位的胞质面(将形成有被小泡的外衣)有一些蛋白附着:网格蛋白是其中最主要的一种蛋白。它是一种纤维蛋白,与另一种较小的多肽形成了有被小泡外衣的结构单位,即三腿蛋白复合物。三腿蛋白复合物包括三个网格蛋白和三个较小的多肽。由许多三腿蛋白复合物聚合构成五边形或六边形的网格样结构,覆于有被小泡或有被小窝的胞质面。由网格蛋白装配成的外衣提供了牵动质膜的机械力,导致有被小窝的下凹,也有助于捕获膜上的特异受体及与之结合的被转运分子;调节素是有被小泡中组成外衣的另一类重要的蛋白,它是多亚基的复合物,能识别特异的跨膜蛋白受体,并将其连接至三腿蛋白复合物上,起选择性介导作用。跨膜受体蛋白胞质面肽链尾部,常在一个由四个氨基酸残基构成的区域内高度转折,形成一个内吞信号,由调节素识别它。所以调节素可介导不同类型受体,使细胞能捕获不同类型的物质。
保证细胞正常分裂
2012年9月,美国加州大学旧金山分校生物工程与治疗科学系教授弗朗西斯·布罗茨基和她的研究小组发现,如果没有网格蛋白,细胞分裂会变得极不规律,而这正是癌症等人类疾病的一个特征之一。
研究人员通过RNA干扰技术,向原有基因中注入一小段基因片段,以阻止网格蛋白的生成,删除了细胞中的网格蛋白。结果发现,在没有网格细胞的情况下,细胞分裂过程中中心体内的中心粒不是成对出现,而是毫无规律且越来越多。在经过进一步的筛选和识别后,布罗茨基的小组发现真正起作用的是一种名为CHC17的网格蛋白。如果删除CHC17或用化学方法使其钝化,就会导致细胞外观异常。
网格蛋白
通常当一个细胞分裂时,会产生结构蛋白形成纺锤体,并以此来分裂成两个具有同样DNA的新细胞。在删除网格蛋白后,这一过程的对称性和稳定性就遭到了破坏。这说明网格蛋白对细胞分裂至关重要。该发现找到了网格蛋白的一项“隐藏功能”,同时也为人们对癌症的认识和治疗提供了一个新角度。

