蛋白质分子(蛋白质分子)

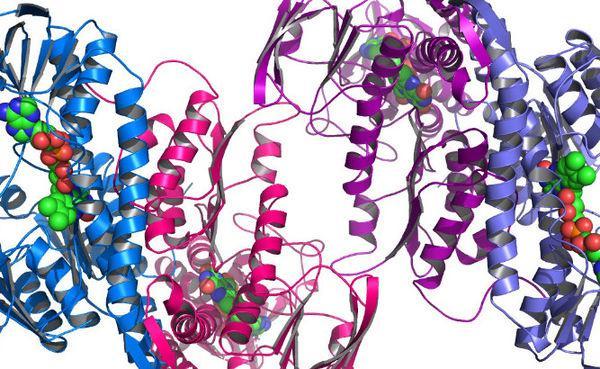
蛋白质分子内各个原子之间相互的立体关系就是蛋白质分子的结构。通常将蛋白质的结构分为一级结构、二级结构、三级结构和四级结构。
蛋白质分子
结构组成
1.蛋白质的一级结构:又称为初级结构或化学结构,是指蛋白质分子中,由肽键连接起来的各种氨基酸的排列顺序。目前可以运用氨基酸自动分析仪和氨基酸顺序自动分析仪,对蛋白质的一级结构进行测定。
2.蛋白质的二级结构:蛋白质的二级结构是指蛋白质分子中多肽链本身的折叠方式。近年来,通过研究知道,蛋白质分子的多肽链本身一般都不是全部以松散的线性分子的状态存在于生物体内,而是部分卷曲盘旋成螺旋状(一般呈所谓α螺旋),或折叠成片层状(又称β折叠),或呈β回折(发夹回折、U形转折),或呈无规则卷曲。蛋白质的二级结构主要依靠氢键来维持结构的稳定性。
3.蛋白质的三级结构:具有二级结构的肽链,按照一定方式再进一步卷曲、盘绕、折叠成一种看来很不规则,而实际上有一定规律性的三维空间结构,叫做三级结构。这些肽链所以会卷曲、盘绕、折叠,主要是因为肽链的氨基酸侧链之间的相互作用。
4.蛋白质的四级结构:具有三级结构的蛋白质分子,通过一些非共价键结合起来,而成为具有生物功能的蛋白质大分子,就是蛋白质的四级结构。构成功能单位的每条肽链,称为亚基。亚基虽然具有二、三级结构,但是在单独存在时并没有生物活力,只有完整的四级结构才具有生物活力。例如,磷酸化酶是由两个亚基构成的,马血红蛋白是由四个不同的亚基(2个α肽链,2个β肽链)构成的,谷氨酸脱氢酶是由六个相同的亚基构成的。
有些蛋白质分子只有一、二、三级结构,并无四级结构,如肌红蛋白、细胞色素c、核糖核酸酶、溶菌酶等。另一些蛋白质,则一、二、三、四级结构同时存在,如血红蛋白、谷氨酸脱氢酶等。
介绍元素
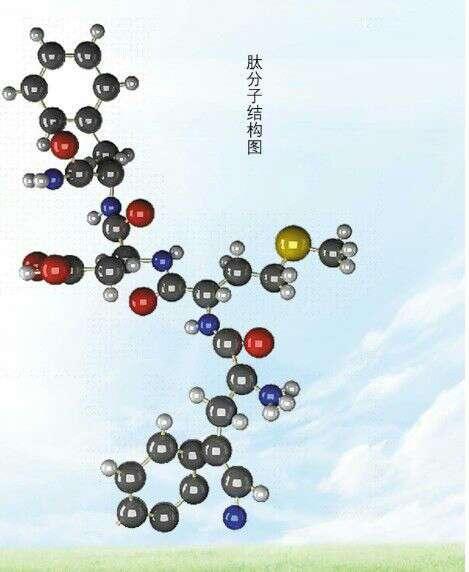
蛋白质分子
由α—氨基酸通过肽键结合而成的天然有机高分子化合物。分子量为6103~106,其元素组成除含碳、氢、氧外,均含氮和少量硫。蛋白质的结构很复杂,多肽链内的多种α—氨基酸以一定顺序排列,肽链上不直接相连的氨基之间通过特殊的分子间力(氢键)结合、盘旋、叠合呈空间结构,因此蛋白质是以多种氨基酸为单体的高聚酰胺。蛋白质种类繁多,水解产物均是α—氨基酸的称为单纯蛋白质。
单纯蛋白质与非蛋白质的结合物叫结合蛋白,如脂蛋白、糖蛋白、血红蛋白等。单纯蛋白质又可分为不溶于水的纤维蛋白,如毛发、丝、爪甲等;可溶于水的球蛋白,如血清蛋白、酶等。研究蛋白质的组成、结构和合成,进一步探索生命现象,是科学研究的重要课题。1965年我国科学家在世界上第一次用人工方法合成了具有生命活力的蛋白质—结晶牛胰岛素。
生命物质
蛋白质分子
由许多氨基酸聚合而成的生物大分子化合物,为生命的最基本物质之一。蛋白质广泛存在于各种生物组织细胞,是生物细胞最重要的组成物质。19世纪有机化学发展后,人们才逐渐认识蛋白质的化学本质。现已证明,蛋白质是由许多氨基酸通过肽键相变而成的。分子巨大,分子量相差很大,一般为数万至数十万。在小中成胶性溶液,不能透过半透膜,原生质的胶态主要由其胶性所形成。分子很不稳定,易受物理或化学因素的影响而变性,丧失其生物活性。分子内有自由氨基和自由羧基,在酸性溶液中带正电荷,在碱性溶液中带负电荷。在等电点pH时溶解度最小。自然界中蛋白质种类繁多,已发现的蛋白质有数万种。根据蛋白质分子的形状,可分为球蛋白和纤维蛋白。球蛋白分子似球形,较易溶解,如血液的血红蛋白,不溶于水,如指甲、羽毛中的角蛋白,蚕丝的蛋白等。根据蛋白质分子组成繁简,可分为简单蛋白质和结合蛋白。简单蛋白分子、球蛋白、谷蛋白和硬蛋白等。结合蛋白分子由简单蛋白与非蛋白物质结合而成,如血红蛋白、糖蛋白、脂蛋白和核蛋白和核蛋白等。蛋白质是生命活动的物质基础,生命活动几乎都是通过蛋白质实现的,有的蛋白质在生物体内是结构物质,有的蛋白质在生物体内是功能物质。人和高等动物的肌肉收缩和舒张过程是由许多种蛋白质协同作用的结果;促进和决定生物体内化学反应的酶,调节生理系列化活动的某些微素也是蛋白质;血液中输送氧的血红蛋白、防御病菌感染的免疫球蛋白等也都是蛋白质。人体摄入
蛋白质是人类生活中不可缺少的物质。人类食用蛋白质的70%来自粮食作物。农业科研工作中一项重要的任务是通过育种工作更多地培育出蛋白质含量高的优良品种。许多蛋白质可作药物,如胰岛素、干扰素、免疫球蛋白等等。许多疾病与蛋白质分子病变有关,如镰刀型红细胞贫血症就是由于血红蛋白分子上某个氨基酸发生变异而引起的。仪器制造、酶制剂生产以及丝绸和皮革生产都与蛋白质直接有关。80年代兴起的蛋白质工和将使人们可以按意愿设计并定向制造出新型的蛋白质以造福于人类。
发展简史
蛋白质分子
结构分析和遗传物质的研究在分子生物学的发展中作出了重要的贡献。结构分析的中心内容是通过阐明生物分子的三维结构来解释细胞的生理功能。1912年英国布喇格父子建立了X射线晶体学,成功地测定了一些相当复杂的分子以及蛋白质的结构。以后布喇格的学生阿斯特伯里和贝尔纳又分别对毛发、肌肉等纤维蛋白以及胃蛋白酶、烟草花叶病毒等进行了初步的结构分析。他们的工作为后来生物大分子结晶学的形成和发展奠定了基础。
20世纪50年代是分子生物学作为一门独立的分支学科脱颖而出并迅速发展的年代。首先在蛋白质结构分析方面,1951年提出了α-螺旋结构,描述了蛋白质分子中肽链的一种构象。1955年桑格完成了胰岛素的氨基酸序列的测定。接着肯德鲁和佩鲁茨在X射线分析中应用重原子同晶置换技术和计算机技术,分别于1957和1959年阐明了鲸肌红蛋白和马血红蛋白的立体结构。1965年中国科学家合成了有生物活性的胰岛素,首先实现了蛋白质的人工合成。
另一方面,德尔布吕克小组从1936年起选择噬菌体为对象开始探索基因之谜。噬菌体感染寄主后半小时内就复制出几百个同样的子代噬菌体颗粒,因此是研究生物体自我复制的理想材料。
1940年比德尔和塔特姆提出了“一个基因,一个酶”的假设,即基因的功能在于决定酶的结构,且一个基因仅决定一个酶的结构。但在当时基因的本质并不清楚。1944年埃弗里等研究细菌中的转化现象,证明了DNA是遗传物质。
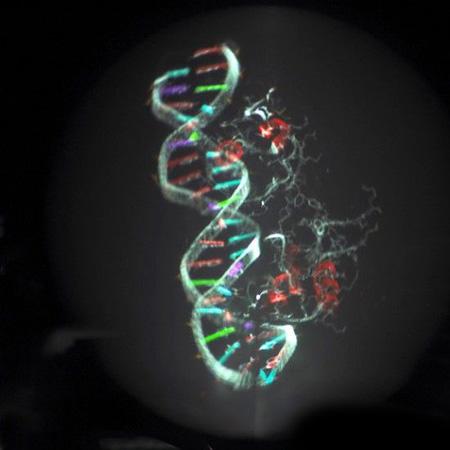
1953年沃森和克里克提出了DNA双螺旋结构,开创了分子生物学的新纪元。并在此基础上提出的中心法则,描述了遗传信息从基因到蛋白质结构的流动。
遗传密码的阐明则揭示了生物体内遗传信息的贮存方式。1961年雅各布和莫诺提出了操纵子的概念,解释了原核基因表达的调控。到20世纪60年代中期,关于DNA自我复制和转录生成RNA的一般性质已基本清楚,基因的奥秘也随之开始解开了。
仅仅三十年左右的时间,分子生物学经历了从大胆的科学假说,到经过大量的实验研究,从而建立了本学科的理论基础。进入70年代,由于重组DNA研究的突破,基因工程已经在实际应用中开花结果,根据人的意愿改造蛋白质结构的蛋白质工程也已经成为现实。
水平研究
蛋白质分子
作为生命活动主要物质基础的生物大分子结构与功能,从而阐明生命现象本质的科学。重点研究下述领域:(1)蛋白质(包括酶)的结构和功能。
(2)核酸的结构和功能,包括遗传信息的传递。
(3)生物膜的结构和功能。
(4)生物调控的分子基础。
(5)生物进化。
分子生物学是第二次世界大战后,由生物化学、`遗传学、微生物学、病毒学、结构分析及高分子化学等不同研究领域结合而形成的一门交叉科学。目前分子生物学已发展成生命科学中的带头学科。


