反义技术(反义技术)


反义技术是通过碱基互补原理,干扰基因的解旋、复制、转录、mRNA的剪接加工乃至输出和翻译等各个环节,从而调节细胞的生长、分化等。 1998年,第一个反义药物Vitravene(Fomivirsen)被美国FDA批准通过,2013年,赛诺菲旗下Genzyme的寡核苷酸药物Mipomersen上市;2016年9月和12月,FDA又批准两款小核酸药物上市。
反义技术
碱基互补原理
1998年
调节细胞的生长、分化
基本介绍
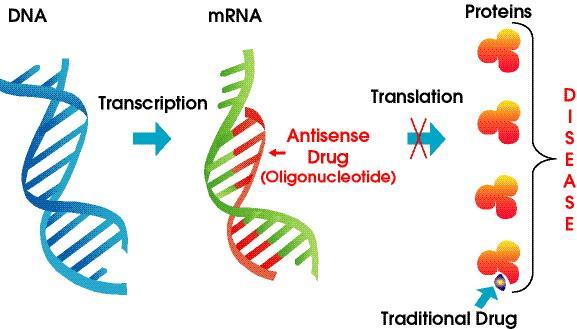
反义技术
反义寡核苷酸是一类经人工合成或构建的反义表达载体表达的寡核苷酸片段,长度多为15-30个核苷酸。根据结合部位的不同分为反义DNA(asDNA)、反义RNA(asRNA)、自催化性核酶(ribozyme),后者为具有酶活性的反义分子,可裂解与其互补的mRNA及在DNA内插入DNA片段构成三链结构,但最常用的为反义寡脱氧核苷酸(反义寡核苷酸),其优点在于其理论上的高度靶特异性(碱基互补)、设计容易、多样且合成简单及高度的局部性和针对性。这都是常规药物设计、生产和作用所不可比拟的,因而具有巨大的吸引力和研究价值。传统药物大多与蛋白质结合,从而修饰蛋白质的功能。相比之下,反义试剂在mRNA (DNA)水平上发挥作用,阻止其翻译成蛋白质。最近几年来,新的用于保护寡聚核苷酸免遭酶解、提高靶标亲和性的化学修饰技术的发展,使得反义技术也获得巨大进步。另外,RNA干扰(RNA interference)成为第三代抑制哺乳动物细胞基因表达的高效方法,该技术采用了21-23个残基组成的小干扰RNA分子(siRNA)。优点介绍
反义技术具有明显的优点
:(1)反义核苷酸是针对特定的靶mRNA(DNA)的序列设计合成,具有极高的特异性;
(2)反义核酸是针对已知序列的靶基因设计合成的,由于靶基因序列已知,反义核酸仅有15-30个碱基,结构简单,容易设计和体外大量合成。
(3)反义核酸进入细胞内与细胞周期无关,既可进入增殖期细胞又可进入非增殖期细胞。
(4)反义寡核苷酸不含病毒序列,不会产生免疫反应,也不会整合入宿主染色体内
相关应用
反义核酸的来源确定靶基因后,针对该基因的外源反义核酸片段的设计合成有两种途径:
(1)重组于表达载体产生反义核酸片段,即利用DNA重组技术,在适宜的启动子和终止子间反向插入一段DNA于质粒中,构建于反义表达载体来合成反义核酸;
(2)人工合成反义寡核苷酸,即根据选定的靶基因序列,按照碱基互补原则,设计出反义寡核苷酸序列,以DNA自动合成仪进行合成。
反义核酸必须满足的标准(1)反义核酸在体内是稳定的;
(2)反义核酸必须能够进入细胞内,并与靶基因有较高的亲合力,且在作用浓度下不表现出明显的细胞毒性;
(3)与靶序列的杂交能使靶基因的表达受抑制,且不作用于其它核酸序列及胞内蛋白和类脂化合物。
反义核酸的长度为使反义核酸序列只作用于唯一的靶基因,其最短序列应是12-15个碱基,实验中的反义核酸多是15-30个碱基。增加反义核酸序列的长度可以提高其结合能力及杂交复合体的稳定性,但同时也增加了与其它mRNA非特异性同源序列结合的机会,并使其进入细胞内的能力降低。
靶基因序列的选择大部分反义核酸是在胞浆内与靶基因序列作用而形成杂交复合体的,所以靶基因(mRNA)中二级结构少或无的区域,也就是mRNA启动子周围的序列,是反义核酸的理想作用位点。对于核内的mRNA,参与其加工和外运的序列以及剪接位点处的序列是有效的靶基因序列。另外,5’-帽端是多数起动子的结合位点,也是有效的靶基因区。
反义核酸的化学修饰反义技术的一个重大挑战是寡聚核苷酸的稳定性,因为未经修饰的寡聚核苷酸在生物体内会被核酸酶迅速降解。反义实验中应用到大量的化学修饰的核苷酸。一般来说,核苷酸的修饰分为三类:非天然碱基的类似物、经过修饰的糖(尤其是核糖的2'位置)、改变的磷酸骨架。
硫代磷酸酯寡聚脱氧核糖核酸(Phosphorothioate DNA Oligonucleotides,PS DNA ON)是第一代DNA类似物的主要代表,被认为是至今为止了解最多和应用最广泛的反义寡聚核苷酸。在这一类寡聚核苷酸中,磷酸二酯键中的非桥氧原子被置换成硫原子。PS DNA ON的主要缺点是能与一些蛋白结合,这可以引起细胞毒性。但从药物动力学角度来看却是有利的。与血浆蛋白的结合可以保护它们免遭过滤,使得它们在血清中的半衰期延长。PS DNA ON的另外一个缺点是与互补RNA的亲和性会稍微降低与硫代磷酸酯寡聚脱氧核苷酸相关的问题在第二代寡聚核苷酸中得到一定程度的解决。第二代寡聚核苷酸在核糖的2'位置含有烷基修饰。2'-O-甲基和2'-O-乙基是这类修饰的两个重要成员。具有这种修饰的寡聚核苷酸比硫代磷酸酯DNA的毒性低,并且与互补RNA的亲和性也得到了稍微提高。然而这些有利的性质被2'-O-烷基RNA不能激活RNaseH切割靶RNA这个缺点所抵消。
最近几年,有多种经过修饰的核酸被开发,用于提高靶标亲和性、核酸酶抗性和药物动力学性质。“构像限制”的概念被广泛用于提高亲和性和生物稳定性。这些新类型的核酸被归为“第三代”反义试剂。
反义核酸导入体内的载体为提高反义核酸的局部转染率,使其最大量地进入细胞内,可通过一定运载系统将外源反义核酸通过上述方法转移至局部细胞。常用载体有:
(1)脂质体:将反义核酸的负电荷包裹后形成更易穿过细胞膜的脂溶性复合体,可明显提高细胞的摄取能力,常用的脂质体为阳离子脂质体,如DOTMA和DOTAP。
(2)病毒脂质体运载系统:可明显提高转染率。
(3)病毒:主要有逆转录病毒和腺病毒,前者主要作用于增生期细胞,转染率低,但与宿主细胞核的整合能力强,整合后稳定性强,可持续表达五个月以上;后者目前研究较多的是复制缺陷腺病毒,可作用于增殖期和静止期细胞,转染率高,但整合能力和稳定性均较低,其细胞毒性和免疫反应及感染生殖腺细胞限制了其在体内的应用。
(4)其它:如受体介导等,目前应用尚不广泛。
对于体外人工合成的反义寡核苷酸,主要应用脂质体、病毒脂质体运载系统或不用载体而直接局部给药,对于应用基因重组方法构建的反义核酸表达载体,可用脂质体或病毒载体一次性给药,使其进入细胞内后不断产生反义核酸(细胞增殖时表达),达到长期抑制的目的。
反义核酸的吸收与分布反义核酸的吸收取决于其序列长度、荷电量、水/脂溶性及其浓度。荧光吖啶标记的未修饰的核酸是通过受体介导的细胞内吞作用进入细胞内的,且已分离出分子量分别为34KD和80KD的两种膜表面蛋白。对于修饰过的反义核酸,其主要吸收机制有所不同,但多数细胞表现为温度及能量依赖性的细胞颗粒内吞作用,37℃时吸收量最大。核素及荧光标记的反义核酸在大多数细胞中先以颗粒形式内化(Internalization)于内吞小泡中,后期可达细胞核内。
反义核酸的作用机制反义寡核苷酸抑制靶基因表达的确切机制尚不完全清楚。一般认为有特异性和非特异性机制两种。
特异性机制是指反义寡核苷酸与靶序列结合后通过以下途径抑制靶基因的表达:
(1)与DNA结合成三链结构或与单链DNA结合成双链结构以阻止靶基因的复制或转录;
(2)与靶mRNA结合形成双链杂交体激活核酸酶H,裂解靶mRNA阻断蛋白质的翻译;
(3)与mRNA AP位点结合干扰其剪接、加工和运输以终止蛋白质的翻译;
(4)占据酶结合位点,表达核酶,降解靶mRNA。
非特异性机制指非序列特异性药理学效应,或与细胞蛋白间反应,为许多双链核酸所共有,如双链RNA(dsRNA)增加IFN的合成,激活两种IFN诱导基因:2’,5’-寡腺苷酸合成酶(2’,5’-AS)和蛋白激酶P60。前者激活核酸内切酶RnaseL降解靶mRNA,后者使真核细胞起始因子2(CIF-2)的α亚单位磷酸化导致启动mRNA的翻译失败,从而抑制蛋白质的合成。dsRNA尚能活化腺苷酸环化酶使cAMP浓度升高。另外,尚有dsRNA诱导内皮细胞IL-1α表达的报道。
当然,反义寡核苷酸的非特异性效应有可能导致细胞毒性。体外大多数细胞能耐受100μmol/L浓度的反义寡核苷酸。
反义核酸的毒副作用反义核酸的细胞毒作用与核酸的化学修饰基因、序列长度及作用浓度和时间有关。一般而言,核酸序列愈长、作用浓度愈大、时间愈久,毒性作用愈大。有关反义核酸在体内的毒性研究较少,静脉或腹腔注射硫代磷酸核苷酸后,在体内迅速再分布,T1/2≈10-60分钟,主要经过尿液排泄,清除时间较长,约20-40小时,这表明可以不必大量反复用药即可使靶组织中具有一定治疗浓度的反义核酸。然而,反义核苷酸可在如心、胃、肠等脏器中明显聚集,这些非靶器官中集聚的反义核酸可产生非特异性地蛋白合成抑制作用,尤其是对骨髓和小肠等增生旺盛的器官;同时寡核苷酸降解后剩余的化学修饰碱基有掺合入DNA而引起突变或干扰DNA修复的可能。而局部应用反义核苷酸可明显减少其对远处组织的毒性作用。
临床实验现状
反义技术应用广泛,可以用于治疗多种疾病,包括病毒感染、癌症和炎症(总结如下表)。
Product Company Target Disease Chemistry Status
Vitravene (Fomivirsen) ISIS Pharmaceuticals CMV IE2 CMV retinitis PS DNA Approved
Affinitac (ISIS 3521) ISIS PKC- Cancer PS DNA Phase III
Genasense Genta Bcl2 Cancer PS DNA Phase III
Alicaforsen (ISIS 2302) ISIS ICAM-1 Psoriasis, Crohn's disease, Ulcerative colitis PS DNA Phase II/III
ISIS 14803 ISIS Antiviral Hepatitis C PS DNA Phase II
ISIS 2503 ISIS H-ras Cancer PS DNA Phase II
MG98 Methylgene DNA methyl transferase Solid tumors PS DNA Phase II
EPI-2010 EpiGenesis Pharmaceuticals Adenosine A1 receptor Asthma PS DNA Phase II
GTI 2040 Lorus Therapeutics Ribonucleotide reductase (R2) Cancer PS DNA Phase II
ISIS 104838 ISIS TNF Rheumatoid Arthritis, Psoriasis 2nd generation Phase II
Avi4126 AVI BioPharma c-myc Restenosis, cancer, Polycystic kidney disease 3rd generation Phase I/II
Gem231 Hybridon PKA RI Solid tumors 2nd generation Phase I/II
Gem92 Hybridon HIV gag AIDS 2nd generation Phase I
GTI 2051 Lorus Therapeutics Ribonucleotide reductase (R1) Cancer PS DNA Phase I
Avi4557 AVI BioPharma CYP3A4 Metabolic redirection of approved drugs 3rd generation Phase I
1998年,第一个(也是至今为止唯一的一个)反义药物Vitravene(Fomivirsen)被美国FDA批准通过。这种硫代磷酸酯DNA被注射入玻璃体内,以治疗由巨细胞病毒(Cytomegalovirus)引起的艾滋病人的视网膜炎。Vitravene获得批准是参与反义领域的公司的一个里程碑。这种药物满足了感染者的需要,但是它的用处非常稀少,以至于只为ISIS制药公司(USA)和Novartis公司(Switzerland)2001年带来了15万7千美元销售收入。
一些第二代寡核苷酸达到了临床试验阶段。抗TNFa的ISIS 104838正被用于治疗炎症的实验,比如风湿性关节炎和牛皮癣。Hybridon公司(USA)正在尝试利用第二代反义分子治疗癌症和艾滋病病毒感染。核苷之间由硫代磷酸酯链接、两端为四个2'-O-甲基核苷酸组成的混合骨架寡核苷酸被证明口服后在小鼠中有抗肿瘤活性。
现在用的最广泛的反义分子仍然是硫代磷酸酯寡聚脱氧核苷酸,但是一些第二代和第三代化学分子正在进行实验并且看来将提供更好的药物动力学性质和口服给药的机会。
相关问题
总的来说,越来越多的反义寡核苷酸进入不同阶段的临床研究,并且涉及到越来越多的疾病,但目前仍存在一些问题亟待解决,一是反义技术的应用方面,包括:
(1)对反义核苷酸的化学修饰以提高其稳定性,延长其半衰期,增加其作用时间;
(2)反义核苷酸的转移系统,尤其是局部腔内转移系统,包括载体系统的研究,使其靶组织最大效率地吸收反义核酸,以提高其作用效果;
(3)反义核酸作用机制的研究。
二是在临床水平,主要是反义核酸的应用剂量和作用时间及对降解产物毒性的作用研究,靶基因的选择及应用反义核酸的最佳时间。
总之,反义技术是一很有前途的基因治疗方法。第三代核苷酸中的一些已经被成功的应用于体内。在研究中已显示出极好的临床应用前景,对以上问题的解决将使其日臻完善,为更多疾病提供有力的临床可行的治疗手段。
随着分子生物学和遗传工程的发展,基因治疗应运而生,反义技术是其中一种,它的基础是根据核酸杂交原理设计针对特定靶序列的反义核酸,从而抑制特定基因的表达,包括反义RNA、反义DNA及核酶(Ribozyme),它们通过人工合成和生物合成获得。
(一)反义RNA,根据反义RNA的作用机制可将其分为3类:Ⅰ类反义RNA直接作用于靶mRNA的S D序列和(或)部分编码区,直接抑制翻译,或与靶mRNA结合形成双链RNA,从而易被RNA酶Ⅲ 降解;Ⅱ类反义RNA与mRNA的非编码区结合,引起mRNA构象变化,抑制翻译;Ⅲ类反义RNA则直接抑制靶mRNA的转录。
(二)反义DNA是指一段能与特定的DNA或RNA以碱基互补配对的方式结合,并阻止其转录和翻译的短核酸片段,主要指反义寡核苷酸,因更具药用价值而倍受重视。
(三)核酶(ribozyme)是具有酶活性的RNA,主要参加RNA的加工与成熟。天然核酶可分为四类:(1)异体催化剪切型,如RNaseP;(2)自体催化的剪切型,如植物类病毒、拟病毒和卫星RNA;(3)第一组内含子自我剪接型,如四膜虫大核26SrRNA;(4)第二组内含子自我剪接型。利用反义技术研制的药物称反义药物。反义药物作用于产生蛋白的基因,因此可广泛应用于多种疾病的治疗,如传染病、炎症、心血管疾病及肿瘤等。与传统药物比较反义药物更具选择性及效率,因此也更高效低毒。基于上述特点反义药物已成为药物研究和开发的热点。而且反义技术还可以应用于生物科学的基础研究。


