铝(有色金属)

VLoG
次浏览
更新时间:2023-05-19
铝
有色金属

铝(英语:Aluminum),铝是一种发现历史短、用途极其广泛的新型轻金属。
基本信息
英文名
Aluminum
元素符号
Al
原子序数
13
族
ⅢA族
周期
第三周期
物理性质
物态
固态
密度
2.698 g·cm⁻³(20 ℃)
熔点
660.24 ℃(高纯铝99.99%)
沸点
2060 ℃(高纯铝99.99%)
水溶性
3.961×10⁵ J·kg⁻¹
比热容
934.92 J·(kg·K)⁻¹(100 ℃)
铝位于门捷列夫元素周期表的第三周期第ⅢA族,化学元素符号为Al,原子量26.981454,原子序数为13,立方晶系,立方面心晶格。无同素异构转变,常见化合价为+3价,是一种银白色的轻金属,20 ℃时,密度为2.698 g·cm⁻³,高纯铝(99.99%)的熔点为660.24 ℃,沸点为2060 ℃。[2]铝的化学性质十分活泼,自然界中仅发现了极少量游离态的铝,其绝大部分是以化合态的形式与其他矿物共生。含铝的矿物总计有250多种,主要的是铝土矿、高岭土、霞石、明矾石、黏土等。
事实上,黏土本身就是一种主要为硅铝酸盐的矿物,所以人类利用铝的历史非常悠久,因为从史前时代开始,人们就利用各类黏土烧制陶器。除此之外,铝也应用于航空航天、公路、食品、医药、电子产品和传输导线等领域。铝是一种低毒性化合物,在工业应用和日常生活中接触过多,则会对人身造成伤害。
发现历史
铝的英文名称“aluminum”一词是从古罗马语“alumen”(明矾)衍生而来的。
50年代初,考古学者在西晋周处(公元249-297)墓中发现铝质带饰,光谱分析含Al超过90%。
中世纪,历史学家帕拉塞斯(P.A.T.Paracesus)使铝的发展更进一步,:他研究了许多物质和金属,其中也包括明矾(硫酸铝),证实它们是“某种矾土盐”。
1754年,德国化学家马格拉夫(A.S.Marggraf)终于能够分离帕拉塞斯提到过的物质“矾土”。[5]但是,直到1807年,英国人戴维才把“隐藏”在明矾中的金属分离出来,他用电解法发现了钾和钠,却没能分解氧化铝。
1825年,丹麦科学家汉斯·克利斯季安·艾尔斯捷德在一家科技杂志上发表论文写道,他进行试验得到了一块金属,颜色和光泽有些像锡。其实这块新金属就是后来用途很广泛的铝。
1827年,德国化学家弗利德利赫·维列尔着手研究这块新金属,终于年底发表了制取新金属铝的方法。当时维列尔的方法只能分离出颗粒状的铝,继续实验最后才制得了高质量的铝。
人们发现铝之后,铝的矿产资源逐年减少,并且从铝土矿的开采、氧化铝的生产、铝的电解冶炼到铝加工成品,需要消耗大量的能源和原材料,生产成本昂贵,污染环境、影响人类的健康。不过铝有很高的回收与再生性,为了节约成本,人们逐渐将目光转向发展再生铝工业。
分布情况
铝是地壳中分布最广、储量最多的金属元素之一,约占地壳总质量的8.2%,仅次于氧和硅,比铁(约占5.1%)、镁(约占2.1%)和钛(约占0.6%)的总和还多。[2]在火成岩中由铝和氧结合形成的矿物的质量中40%-60%为Al₂O₃,其他为SiO₂、Fe₂O₃等杂质。单独的氧化铝矿有铝土矿、薄水铝矿(α-Al₂O₃·H₂O)、刚玉(Al₂O₃)等,和硅酸盐结合在一起的有长石。高岭土含铝约20%,蒙脱土中含铝约11%。[10]含有长石的岩石(花岗岩、片麻岩、斑岩等)受空气中二氧化碳与水分的作用发生风化,生成可溶性的碱土金属碳酸氢盐和碱金属硅酸盐,它们是植物的重要滋养料,而不溶性硅酸铝则残存下来形成粘土土壤。刚玉与刚玉砂的化学成分是氧化铝(Al₂O₃)。含有微量其他金属而带颜色的结晶刚玉是贵重的宝石(蓝宝石,红宝石)。苏联、美国、意大利、北美的阿肯色河与南美的瓜雅那等地拥有巨大的铝矾土矿。德国只在顽格尔斯堡的西部有一个很小的矿产地。苏联的巨大铝矾土矿分布在乌拉尔北部和中部、齐赫文、哈蘸克斯坦、西伯利亚东部。特别是乌拉尔北部的红帽山矿区出产很高质量的铝矾土。
物质结构
1.塑性好,强度低。铝具有面心立方晶体结构,结晶后无同素异构转变,表现出极好的塑性,适于冷加工成形。[12]可以采用多种方式(轧制、挤压、模锻、冷冲、弯曲等)加工成多种复杂形状的材料与构件。
2.铝原子的外围电子构型为3s²3p¹,在化合物中经常表现为+3氧化态。铝原子有空的3d轨道,与电子对给予体能形成配位数是6或4的稳定配合物。如:Na₃[AlF₆]等。
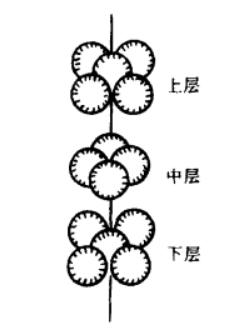
²⁷Al的原子核内有14个中子和13个质子,13个电子在各层轨道上的分布是1s²2s²2p⁶3s²3p¹。如果同时失去2个3s电子和1个3p电子,则生成三价铝离子(Al³⁺);如果失去1个3s电子和1个3p电子,则生成二价铝离子(Al²⁺);如果失去1个3p电子,则生成一价铝离子(Al⁺),低价铝离子在低温下通常不稳定。铝的晶格属于面心立方体型。铝原子(铝离子)位于晶格的节点上和面的中心,这相当于每个晶格内有4个铝原子。
理化性质
物理性质
1.密度小,强度高。单质铝的密度为常数,但在实际使用中铝金属中会含有其他合金元素和杂质,影响其密度,使铝密度增大的元素是Fe、Cu、Mn、V、Cr、Ti、Pb等,使其降低的元素是B、Ca、Mg、Li等。在950 ℃时,铝液的密度为2.303 g/cm³。
2.导电、导热性好。铝的电导率约为铜的60%,如果按单位质量计,铝的电导率则超过了铜,在远距离传输时经常代替铜。
3.耐热性差。200 ℃时强度下降1/3,热膨胀系数大,是铁的2倍。
4.耐蚀性、耐气候性好。铝因为表面能生成硬且致密的氧化薄膜,很多物质它不产生腐蚀作用。
5.低温性能好。-253~0 ℃时,塑性、冲击韧度不降低,随温度下降,强度、塑性升高。
6.工艺性能好。铸造、切削、压力加工性能好。[13]易于挤出形状复杂的中空型材和适用于拉伸加工及其他各种冷热塑性成型。
7.对光、热、电磁波的反射性好。对光的反射率,抛光铝为70%,高纯度铝经过电解抛光的为94%,比银(92%)还高。
8.没有磁性。不产生附加的磁场。
9.熔点低、沸点高。铝的熔点与纯度有密切关系,纯度99.996%的铝,其熔点公认为最精确的测定值为660.24 ℃。纯度99.99%的铝,熔点一般降低1-2 ℃。
10.电阻率小。固体和液体铝的电阻率均随温度降低而减小,靠近0 K时,铝的电阻率接近零。铝表面的氧化膜不仅耐腐蚀的能力,而且有一定的绝缘性。
11.铝可以同多种金属和非金属构成合金。某些合金的力学强度甚至超过结构钢,具有很大的强度/质量比值。
12.铝粉具有银白色的光泽。
13.铝具有吸音性能。
化学性质
从热力学上看,铝是活泼的金属之一,但是在许多氧化性介质、水、大气、大部分中性溶液和许多弱酸性介质与强氧化性介质中,铝具有相当高的稳定性。
1.铝能与氧气发生氧化反应。
(1)铝常温下与氧气反应,形成致密的氧化膜,抗腐蚀性比镁还强。
(2)铝在纯氧或高温下可燃烧,放出大量的热和耀眼的光:
4Al+3O₂=2Al₂O₃(高温条件)
2.耐化学药品。铝在干燥空气中会和氧气反应,在表面生成致密的氧化铝(Al₂O₃)薄膜,能有效防止铝的进一步氧化或与水、稀酸反应,可以用于化学制品、酸和化学品包装等。
3.铝是化学性质很活泼的金属,容易与氧气和各种水溶液反应,因而铝在自然界中很少以游离状态出现。
(1)铝与H₂O反应:
2Al+6H₂O(沸)=2Al(OH)₃+3H₂↑
4.铝在高温下能够还原其他金属氧化物,利用这些反应可制取某些金属。
(1)铝与某些氧化物置换反应:
10Al+3V₂O₅=5Al₂O₃+6V(加热条件)
8Al+3Fe₃O₄=4Al₂O₃+9Fe(加热条件)
5.铝在800 ℃以下温度会与三价铝的卤化物发生反应生成一价铝化合物,并且在冷却时,此反应可逆,可以利用此性质从铝合金中提取纯铝。
(1)Al和一些非金属,如B、Si、P、As等直接反应生成相应的化合物:
4Al+3C=Al₄C₃(2000 ℃条件下)
2Al+Cl₃=2AlCl₃(加热条件)
(2)铝生成的三卤化物
Al³⁺+6F⁻=AlF₆³⁻
6.铝具有酸碱两性性能,铝能与酸起反应,生成铝盐;铝能与苛性碱溶液反应,生成氢气和可溶性铝酸盐。碱和盐会破坏铝表面的氧化膜,降低铝的抗锈蚀性,但是高纯度铝能够抵御某些酸的腐蚀作用。
(1)金属铝在酸性条件下的反应:
2Al+6H⁺=2Al³⁺+3H₂↑
(2)金属铝在碱性条件下的反应:
2Al+2OH⁻+2H₂O=2AlO₂⁻+3H₂↑
(3)铝与非强氧化性酸反应:
2Al+6HCl=2AlCl₃+3H₂↑
(4)铝与强氧化性酸反应:
常温下被浓硫酸、浓硝酸钝化
(5)铝与碱反应:
2Al+2NaOH+2H₂O=2NaAlO₂+3H₂↑
7.铝不与碳氢化合物起反应,但是因碳氢化合物中可能含有碱或酸,也会使铝受到腐蚀。铝不与酒精、酚、醛、酮、醌发生反应,但是铝同醋酸起反应,温度升高,则反应加剧。
化合物
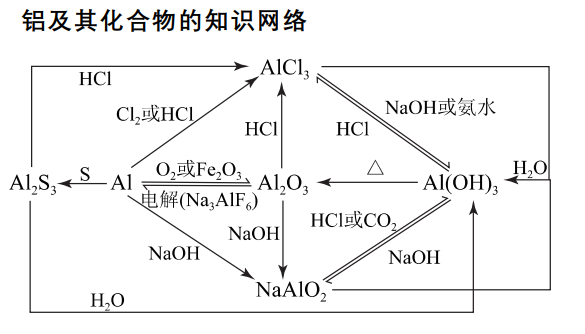
1.金属铝及其化合物反应关系图:
2.无水AIX₃(AlF₃除外)都是缺电子体,是典型的Lewis酸,可以和Lewis碱加合。
C₆H₆+CH₃CH₂Cl→C₈H₁₀(AlCl₃催化条件)
C₆H₆+C₂H₃OCl→C₈H₈O(AlCl₃催化条件)
C₆H₆+(CH₃CO)₂O→C₈H₈O(AlCl₃催化条件)
AlCl₃因为很容易水解,水解形成Al(OH)₃,而絮状的Al(OH)₃在沉降的过程中能够吸附水中的杂质一起沉降而起到净水的作用。
3.铝的含氧化合物:
Al₂O₃有α-Al₂O₃,γ-Al₂O₃,η-Al₂O₃三种形式,后两种Al₂O₃酸碱都溶,而α-Al₂O₃不溶于酸,只能与KHSO₄一起熔融才能转化成可溶性的硫酸盐:
2KHSO₄=H₂O+K₂S₂O₇(加热条件)
Al₂O₃+3K₂S₂O₇=3K₂SO₄+Al₂(SO₄)₃
同位素
铝一共有22个已知同位素,质量数在22-43之间,这些同位素中,只有²⁷Al是稳定的,其他都具有放射性。
剩余的同位素中²⁶Al最稳定,²⁶Al的大气产生远远低于¹⁴C或¹⁰Be,因为其母体40Ar仅占大气气体的1%。由于宇宙射线的大气衰减,地球表面就地产生也是低的。因此,²⁶Al的首次研究是月球与陨石,陨石碎片在它们通过空间过程中暴露于强烈的宇宙射线轰击,产生大量的²⁶Al。²⁶Al也可以通过β⁺衰变生成¹²Mg在应用上被用于陨石年龄的测定。²⁶Al的半衰期为72万年。除此之外,²⁴Al半衰期只有2.1秒,²⁹Al半衰期6.6分,³⁰Al半衰期3.3秒,²⁸Al半衰期为2.31分。
毒性
铝有低毒性,是一种慢性积蓄性神经毒素。过量的铝还会在类骨质中置换出钙并导致软骨症。
制备方法
1.铝的冶炼:铝土矿与过量NaOH反应,生成NaAlO₂,再加入CO₂,生成Al(OH)₃,加热则可生成Al₂O₃,电解生成Al。
2.制备金属铝的工业方法:在加压条件下,用NaOH溶液处理铝土矿得到NaAl(OH)₄,将氧化铝溶解在熔融的冰晶石中电解。
Al₂O₃+2NaOH+3H₂O=2NaAl(OH)₄
NaAl(OH)₄+CO₂=Al(OH)₃+NaHCO₃
2Al(OH)₃=Al₂O₃+3H₂O(加热条件)
将制备出的Al₂O₃进行电解,熔融冰晶石是溶剂,氧化铝作为溶质,以碳素体作为阳极,铝液作为阴极,通入强大的直流电后,在950-970 ℃下,在电解槽内的两极上进行电化学反应,即电解。阳极上发生的反应式:2O²⁻+C-4e=CO₂,阴极上发生的反应式:Al³⁺+3e=Al
3.偏析法
偏析法又称凝固提纯法,是利用熔融铝凝固(结晶)时产生偏析现象而提取高纯铝的方法。通常将Wɑ称为某种杂质在固态铝中的含量,而Wʟ代表某种杂质在铝熔体中的含量,而将叫Wɑ/Wʟ的比值称为平衡分配系数(Ko=Wɑ/Wʟ)。凡是Ko小于1的杂质如Si、Fe、Cu、Zn、U、Th等都可以通过偏析法在一定程度上除去;而Ko大于1的如Ti(Ko=8.0)、Cr(Ko=2)等则不能采用偏析法除去,因为这时它们在固态铝中的含量会大于熔体中的。通过多次偏析反复提纯就可以获得5N级的高纯铝。
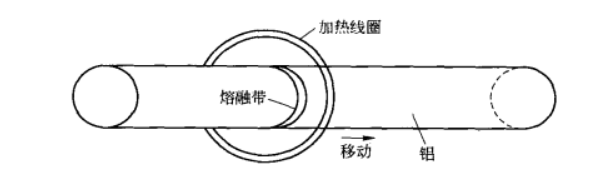
4.区域熔炼法
区域熔炼法或区域提纯法其原理与偏析法相同。
生产中将高纯铝棒置入特制加热炉(器)内,并缓慢移动此区,利用杂质在固相与液相间的溶解度差异(偏析)除去铝中的杂质。当熔融区自左向右缓慢移动时,分配系数Ko小于1的杂质就会逐渐向右边富集;反之,则向左边富集。一次区域提纯往往达不到所要求程度,因此需要重复提纯多次,或者用一系列的加热器,在同一根铝棒上产生几个熔融区,让它们在一次操作时先后通过原料铝棒。铝棒右段含杂质较多,左段即是纯度高的超纯铝或极纯铝。 5.有机溶液电解法
为制备超高纯铝,可以使用高纯铝(4N)作为阳极进行有机溶液电解,得到的阴极高纯铝中杂质含量也较少。目前主要选用烷基铝(如三乙基铝)与氟化钠的配合物作为电解溶液。提纯原理:因为铝比氢活泼,故不能从水溶液中电解出铝,但是可以使用铝的有机化合物或配合物作为电解溶液,铝从阳极溶解后,电解液中铝在阴极析出。
6.泡沫铝的制备。泡沫铝是一种在金属铝基体中分布有无数气泡的多孔质材料。根据制备过程中铝的状态可以分为三大类:液相法、固相法和电沉积法。
液相法:通过液态铝产生泡沫结构,可在铝液中直接发泡,也可用高分子泡沫或紧密堆积的造孔剂铸造来得到多孔材料。
固相法:用铝粉末代替液态铝同样可制得多孔材料。因为大部分固相法通过烧结使铝颗粒互相联结,铝始终保持在固态,所以此法生产的泡沫铝多数具有通孔结构。
电沉积法:以泡沫塑料为基底,经导电化处理后,电沉积铝制成。可通过浸涂导电胶、磁控溅射锡膜或化学镀膜等方法使泡沫塑料导电。由于铝的电极电位比氢还负,所以不可以采用铝盐水溶液电镀,可采用烷基铝镀液。用电沉积法生产的泡沫铝具有孔径小、孔隙均匀、孔隙率高等特点,其隔热性能和阻尼特性优于铸造法生产的泡沫铝。
应用领域
铝是有色金属中应用范围仅次于钢铁的第二大金属。铝工业现在是世界上最大的电化学冶金工业,铝的产量在金属中仅次于钢铁,居有色金属之首。铝作为各国国民经济发展的基础原材料之一,也是强军强国的重要战略物资,因其具有特殊的化学、物理特性,决定了铝的用途非常广泛。铝被广泛应用在航空航天、公路、铁路、航海、食品、医药、包装、建筑、机械制造、防腐工程、电子产品和传输导线等领域。[2]对于不同晶型的Al₂O₃,γ-Al₂O₃与η-Al₂O₃具有大的表面积,可作催化剂载体。α-Al₂O₃可作人造宝石,根据所含杂质不同显现不同颜色。高温烧结的Al₂O₃硬度大,熔点高,可作耐蚀剂或高温耐火材料。针对铝的不同基本特性对应应用领域举例。
基本特性 | 主要应用领域举例 | 优点 |
质量轻 | 铝制造的物品质量轻,可以节省搬运费和加工费。在实际应用中用于制造飞机、轨道车辆、汽车、船舶、桥梁、高层建筑和质量轻的容器等 | 节省搬运费和加工费用 |
强度好 | 铝合金的强度比普通钢好,针对此性能应用于制造桥梁(特别是吊桥、可动桥)、飞机、压力容器、集装箱、建筑结构材料 | |
工艺性能 | 铝的延展性优良,适宜拉伸、加工各种冷热塑性变形,因此应用于受力结构部件框架,一般用品及各种容器、光学仪器及其他形状复杂的精密零件 | 加工容易 |
美观、适于各种表面处理 | 铝本身具有氧化膜,并且可以通过染色和涂刷等方法,制造出各种颜色和光泽的表面。建筑用壁板、器具装饰、装饰品、标牌、门牌、仪表外壳及室内外装修材料等 | |
耐蚀性、耐气候性好 | 铝表面的致密氧化薄膜,有优良的耐久性。门板、车辆、船舶外部覆盖材料、厨房器具、化学装置、材料、化学药品包装等 | 优良的耐久性 |
耐化学药品 | 用于化学用装置和包装及酸和化学制品包装等 | 对硝酸、冰醋酸、过氧化氢等化学药品有非常好的耐药性 |
导热、导电性好 | 电线、母线接头、锅、电子元件等 | |
对光、热、电磁波的反射性好 | 照明器具、反射镜、冷冻库、投光器、冷暖器的隔热材料 | |
没有磁性 | 船上用的罗盘、天线、操舵室的器具等 | 精密仪器与军事领域不起干扰作用 |
无毒 | 铝本身没有毒性,并且表面光滑、容易清洗,故细菌不易停留繁殖。在实际应用于食具、食品包装、鱼罐、鱼仓、食品容器等方面 | |
有吸音性 | 铝对声音是非传播体,有吸收声波的性能,因此多应用于室内天棚版等 | |
耐低温性 | 低温时,铝的强度增加并且无脆性,是理想的用于低温装置材料。应用于冷藏库、冷冻库、氧及氢的生产装置 | |
绝缘性 | 电器制造工业、电线电缆工业和无线电工业 | 电阻率小 |
放出大量热 | 制造爆炸混合物 | |
活泼金属 | 生产焰火的原料 | 再生利用率高 |
酸碱两性性能 | 储存硝酸、浓硫酸、有机酸和其他化学试剂 |
安全事宜
工业生产铝使用的电解铝方法,属于高能耗、高污染企业,生产工艺相对复杂。在生产过程中会释放出氟化氢、一氧化碳、二氧化碳等有毒有害气体,一般情况下通过呼吸道或皮肤进入人体,当人体吸入一定量后会导致氟骨病的产生,严重时还有可能会造成人员伤亡。对于铝焊工和铝行业的工人来说,当尿液中的铝浓度达到一定标准时,将会出现注意力、学习、记忆表现下降的症状。根据世界卫生组织国际癌症研究机构公布的致癌物清单,铝生产过程在一类致癌物清单中。
在日常生活中,铝是一种低毒性化合物,一旦蓄积在体内常能引起某些中毒性铝病。体内铝的来源主要从消化道摄入,且与每人的膳食内容及饮食习惯有关。因此,在日常生活中做到注意铝食品卫生,控制铝日摄入量,铝日摄入量的控制方法如下:
(1)选购低铝或无铝的食物。对于孕妇、哺乳期妇女、有肾病及慢性肾功能不全的病人更为重要。
(2)注意饮水卫生。城市居民饮用的自来水含铝标准应小于0.2 mg/L。世界卫生组织和美国环保署建议饮用水质规定铝小于50 μg/L。
(3)选用合金铝及不锈钢炊具。不在铝锅中加入酸性食品,以免铝溶出。
(4)少吃油条,少饮浓茶。
(5)不要常饮啤酒。会使血液中铝含量增加,容易造成铝元素在脑中的蓄积。
(6)铝锅烹调虽不会加速维生素C的损失,但不宜用其存放隔夜食物。


