吡啶(含氮杂环有机化合物)

VLoG
次浏览
更新时间:2023-05-23
吡啶
含氮杂环有机化合物
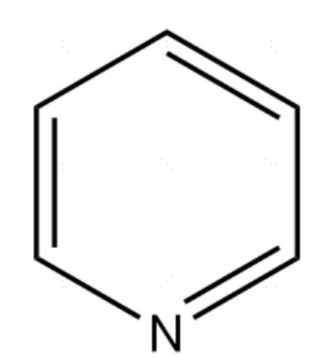
吡啶结构式
吡啶(pyridine)又称为“氮杂苯”,是一种含氮六元杂环化合物,分子式C₅H₅N,沸点115℃,为具有特殊臭味的无色液体,可与水、醇、醚等任意比例混合,能溶解大部分有机化合物和许多无机盐类。吡啶本身呈弱碱性,具有芳香性,其结构与苯相似,由于特殊的“缺π”电子体系,易发生亲核取代反应,主要生成α-位取代产物。吡啶存在于煤焦油中,但由于产率低,目前其主要通过化学合成法制得。吡啶是性能良好的溶剂和有机合成原料,在农业、医药和化学工业等领域被广泛使用。其衍生物也广泛存在于自然界中,是许多天然药物、染料和生物碱的基本组成部分。此外,吡啶中毒无特效解毒药物,以对症支持治疗为主。因此,日常生活中使用吡啶需要谨慎小心。
基本信息
中文名
吡啶
英文名
pyridine
别名
氮杂苯
CAS编号
110-86-1
外观
无色透明液体
熔点
-42℃
密度
0.982g/cm³
水溶性
溶于水、醇、醚和苯等
沸点
115℃
分子式
C₅H₅N
闪点
20℃
发展历史
1851年,苏格兰的化学家托马斯·安德森(Thomas Anderson)从骨焦油中分离出吡啶,通过分馏得到纯品并做了鉴定。随后,化学家Kçrner和Dewar分别在1869年和1871年阐明了吡啶结构,标志着该领域重要化学研究的开始。但煤焦油或骨油中吡啶及其衍生物份量有限,不仅产量少,而且操作效率低。
在20世纪40年代初,随着世界能源结构发生以油代煤的变化,吡啶的来源受到限制,化学合成法成为了获得吡啶的主要途径。1924年,Chichbabin提出大批量生产吡啶及其衍生物的工业方法,以醛和氨为原料,经过对催化剂的不断改进,产率逐渐提高。随着石油天然气工业的发展,以及考虑到原料成本,又出现了以酮、醇、烯等为原料催化合成吡啶及其衍生物的方法,但工艺尚且不成熟而且产率较低。因此,大部分吡啶及其衍生物仍然是以醛和氨作为原料,经催化合成而得。
理化性质
吡啶的结构和物理性质
吡啶的结构与苯相似,可以看做是苯分子中的碳原子被氮原子取代所得到的化合物,吡啶环中的氮原子采用sp²杂化,孤对电子对处于sp²杂化轨道上并指向环外,不参与共轭。6个P轨道构成封闭的共轭体系,有6π电子,符合(4n+2)Hückel规则,因此吡啶具有芳香性。此外,吡啶的极性大于其氢化物六氢吡啶且方向相同。
吡啶为黄色或无色的液体,呈弱碱性,具有恶臭和强刺激性气味;其液体相对密度为0.982,蒸气密度为2.72,熔点-42℃,沸点115℃。此外,由于吡啶环中的氮原子具有较大的电负性,存在未共用的电子对能与水形成氢键、与Cu²⁺、Ag⁺等金属离子配位,所以吡啶具有良好的溶解性,易溶于水和醇、醚等有机溶剂,还可以溶解无机盐,是极具广泛应用价值的溶剂。
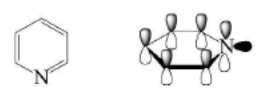
吡啶的分子结构示意图
化学性质
碱性
因为吡啶环氮原子上的未共用电子对容易接受质子,所以吡啶显碱性。吡啶的碱性强于苯胺,弱于脂肪胺。这是由于未共用电子对处于sp²杂化轨道中,s成分较多,电子受核约束较强。吡啶是一个弱碱,能与无机酸生成盐,在合成中常将其作为碱使用,相当于叔胺。此外,其还原产物六氢吡啶(哌啶)则显示出较强的碱性,pKa=11.2,具有仲胺的性质,也是常用的有机碱。
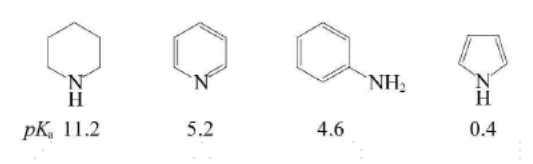
各物质碱性相对强弱比较
亲电取代
吡啶是炔π电子芳杂环。由于氮原子的电负性较大,使得吡啶环上碳原子的电子云密度较苯低,再与质子或Lewiss酸结合后,环上碳原子的电子云密度更低,因而其亲电取代比苯困难。吡啶的亲电取代主要发生在3位。该反应特点有:不发生F-C烷基化、酰基化反应;硝化、磺化、卤化必须在强烈条件下才能发生;吡啶环上有给电子基团时,反应活性增高;吡啶氮原子可以看作是间位定位基。
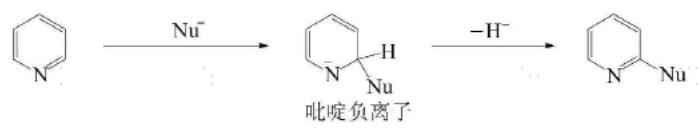
亲核取代
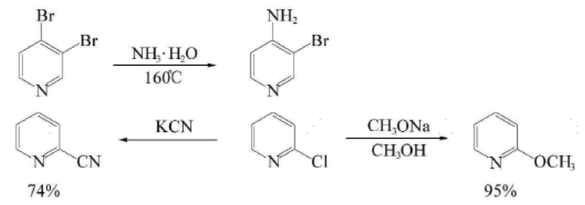
吡啶环上氮原子的作用类似于硝基苯上的硝基,使环上电子云密度降低,所以较为容易发生亲核取代,主要发生在2(4)位。当2-位上有易离去基团(如Cl等)时,较弱的亲核试剂(如NH₃等)就能发生亲核取代反应。该取代主要分为强碱型亲核取代和活化芳香亲核取代。
氧化还原
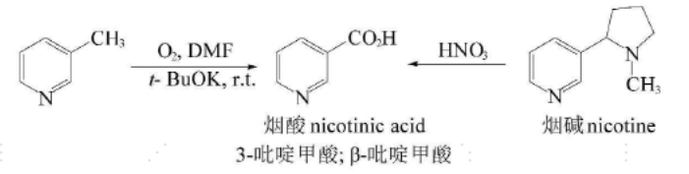
吡啶环由于电子云密度较低,本身不易被氧化,但当吡啶环带有侧链时,其侧链容易被氧化成醛或羧酸。如下所示:
吡啶在特殊氧化条件下可以发生类似叔胺的氧化反应,生成N-氧化物,吡啶N-氧化物同样可以还原脱氧。与氧化反应相反,吡啶环相比苯易被还原,用催化加氢和化学试剂都可以还原,生成六氢吡啶(哌啶)。
配位反应
吡啶类配体具有优异的分子内电子及能量传递性能,大多具有多个配位点,能与多数金属离子形成构型丰富、性能独特的多功能配合物。吡啶类配体数量庞大、种类繁多,根据吡啶类化合物在配合物中的发挥的效力可以分为:螯合配体、桥联配体和多功能配体。
以上三种吡啶类配体由于吡啶环上无其他取代基,亦被称为中性吡啶配体。
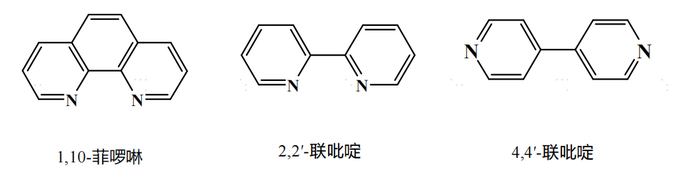
常见的中性吡啶类配体
制备方式
从煤焦油中提取
世界大部分国家都曾采用煤焦油分馏法得到吡啶。通常使用高温炼焦时的饱和器母液作原料,回收提取成粗吡啶,经加热脱渣得水吡啶,再用纯苯共沸脱水得无水吡啶。然后,通过蒸馏切割收集馏分,经过精馏得最终成品。但由于每吨煤焦油中仅含0.03~0.09kg的吡啶及吡啶碱,其含量低且产量小,远远难以满足市场需求,因此开发出了化学合成法,该方法也成为合成吡啶的主要方法。
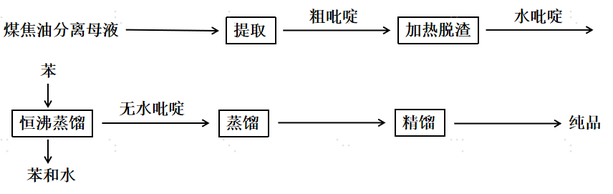
煤焦油分馏法提取吡啶工序流程图
化学合成法
氨-醛法
化学合成法为生产吡啶的主要方法,按反应相可分为液相法和气相法两种,其中又以气相法为主。气相法合成吡啶,按原料分主要可分为氨-醛法、炔-氨法、烯-氨法、醇-氨法、酮-氨法和炔-腈法。而在所述方法中,又以氨-醛法最为重要。
氨-醛法生产工艺是目前世界上应用最广泛的工业路线,普遍采用金属离子改性沸石作为催化剂,此催化剂的发展经历过三个阶段,最初采用非晶形硅铝酸盐,后改为晶形硅铝酸盐,最后是将ZSM-5沸石进行改性,将金属离子通过离子交换处理后引入ZSM-5沸石中,并提高了沸石中的硅-铝比。在大生产中,为了增加反应收率和提高催化剂活性,通常将氨过量,反应在较高温和Al₂O₃-SiO₂催化作用下生成吡啶及吡啶碱。
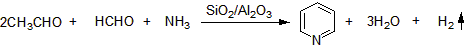
环状化合物转化法
环状化合物转化法主要是以四氢糠醇和氨为原料,在一定温度下,经过某些金属氧化物催化剂(如Cr₂O₃等)的催化生成羟胺,再经过脱水和脱氢生成吡啶的过程。虽然该方法合成的吡啶收率较高,但所用的原料成本较大且对环境有污染,故此方法实用价值不大。
烷基吡啶脱烷基法
烷基吡啶脱烷基法主要针对煤焦油中分离提取得到的甲基吡啶、其他烷基吡啶及合成法中得到的大量的烷基吡啶。其技术研究主要包括催化氧化脱烷基、催化水蒸气脱烷基、催化加氢脱烷基和热解脱烷基等。这种方法多在高温、H₂、和H₂O或空气及催化剂存在的条件下进行,并且未反应的烷基吡啶可以循环利用。
应用领域
吡啶系列原料作为化学工业,特别是精细化工的重要原料,应用范围很广,涉及医药中间体、医药制品、农药、农药中间体、香料及其它多项领域。
在医药方面的应用
此前,吡啶主要被用于医药和溶剂领域。在医药行业,吡啶可用于生产几十种药物,如头孢立新、维生素A、青霉素和局部麻醉药等。
在农药方面的应用
也正因为在农药领域表现优异,该类化合物在生产研发中具有较高的关注度,相应产品在农化领域中应用广泛,市场占比较高。
在香料工业中的应用
吡啶自70年代起,由于所用香域广,应用范围大,已经在日用香精、食用香精中显示出广阔的发展前景。吡啶类香料采用化学合成法合成各类系列的衍生产品,其中以烷基吡啶类香料、烷氧基吡啶类香料、吡啶硫化物等最具开发前景。
烷基吡啶类香料,吡啶与酮在铝或镁存在下进行取代反应,最终可制得系列具有不同香味的2-烷基吡啶;烷氧基吡啶类香料,吡啶氯化制成2-氯吡啶后再与甲醇钠反应可制得酚香香料2-甲氧基吡啶;吡啶硫化物是一类很有应用价值的香料,尤其可用于增香剂。
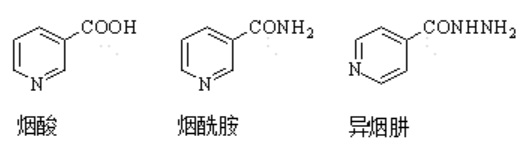
衍生物品
异烟肼(isonicotinic acidhydrazine),又称4-吡啶甲酰肼,商品名叫雷米封,是异烟酸的酰肼,为白色、无臭无味晶体或粉末。具有较强的抗结核作用,可用于肺结核、结核性脑膜炎等方面的治疗。
吡啶衍生物
健康危害
吡啶在世界卫生组织国际癌症研究机构公布的致癌物清单中属于2B类致癌物。
无论是吡啶液体还是吡啶蒸气,都会对人体的健康造成一定的伤害。吡啶可经呼吸道、消化道和皮肤被人体吸收。
若不小心吸入或摄入化学品,轻者表现为眼及上呼吸道刺激症状,伴有胸闷、恶心、头痛;重症会呼吸困难、昏迷甚至大小便失禁,更会对肝、肾造成损害。吡啶中毒,无特效解毒药物,以对症支持治疗为主。此时,应立即将受害人移至新鲜空气处,必要时吸氧;饮足量温水催吐,并立即就医。
若人体的眼睛被吡啶熏蒸,会出现眼刺激症状,角膜灼伤、眼睑水肿、痉挛、角膜上皮脱落、睫状体充血等;若皮肤接触吡啶,会引起原发性刺激或光敏性皮炎,出现皮疹、灼痛、皲裂等症状。此时,应立即用清水彻底冲洗,眼部损伤者冲洗后给予激素和抗生素眼膏交替滴眼,给予对症和支持治疗。


