甲醛(天然有机化合物,最简单的醛)

VLoG
次浏览
更新时间:2023-05-16
甲醛
天然有机化合物,最简单的醛
甲醛(英文名:Formaldehyde),是一种在自然界天然存在的有机化合物,因为其由许多昆虫分泌的酸——甲酸(又称作蚁酸)还原而来,所以又被称作蚁醛。其化学式为HCHO,甲醛分子量为30.026,是有刺激性气味的无色气体。与其他VOC(挥发性有机化合物)一样,它是一种生物源化合物,是生物体代谢的中间产物。甲醛的官能团是羰基,能够发生加成反应、缩合反应、氧化还原反应、聚合反应等。
基本信息

中文名
甲醛
英文名
Formaldehyde,Methanal,Methyl aldehyde,Methyl oxide
别名
蚁醛
拼音
jiǎ quán
CAS号
50-00-0
性质
化学式
HCHO
结构式

外观
纯甲醛为无色气体,甲醛溶液为无色液体
气味
刺激性气味
密度
1.08 g/cm³(25 ℃,101.325 kPa)
熔点
-92 ℃(纯甲醛,101.325 kPa)
沸点
-19 ℃左右(37%甲醛水溶液,101.325 kPa)
溶解性
易溶于水(2x10⁵ mg/L,18 ℃),溶于乙醇、乙醚、丙酮、苯等
log P
0.35
pKa
13.3(25 ℃)
黏度
0.1421 cP(25 ℃)
pH值
2.8-4.0(甲醛溶液)
蒸气压
3890 mmHg(25 ℃)
危险性
NFPA 704

健康评级3:短时间的暴露可能造成严重或永久性损伤 防火等级2:加热或环境温度较高的情况下可以被点燃 不稳定性评级0:通常情况下稳定,火灾的情况下也是如此
闪点
85 ℃(闭杯/气体)
甲醛是重要的化工品,如生产树脂和粘合剂,这些树脂和粘合剂可用于木材产品(例如颗粒和胶合板)。现在,主要采用水溶液和含甲醛的树脂的形式应用甲醛,其水溶液商品中被人熟知的是防腐剂福尔马林(含有质量分数35%~50%左右的甲醛)。
发现及利用历史
1859年,俄国化学家Α.Μ.巴特洛夫(A.M.Butlerov)水解乙酸甲酯时注意到所得溶液的特征气味,首次合成甲醛并且对甲醛溶液、甲醛气体、甲醛聚合物进行了详细描述。1867年,德国化学家奥古斯特·威廉·冯·霍夫曼(August Wilhelm von Hofmann)通过将甲醇蒸气和空气在加热的铂螺旋上进行甲醇脱水的实验,合成并证实了甲醛的存在。1882年德国化学家卡库勒(Kekule)详细描述了纯甲醛的制备方法。
甲醛的工业生产最早可能追溯到1882年,当时托伦斯(Tollens)发现了一种调节甲醇蒸气与空气比值的方法并且以此提高了甲醇脱水反应的产量。1886年,Loew用更有效的铜纱布代替了铂螺旋催化剂又使得甲醛产量提高。1889年,一家德国公司开始在商业规模上制造甲醛并将甲醛市场化。另一家德国公司雨果·布兰(Hugo Blank)在1910年首次申请了使用银催化剂的专利。此后,甲醛生产工业发展迅速,工厂流量,产量和效率都得到了提高。到了1925年,全球比较大的规模工业生产开始发展。1931年,美国化学家阿德金斯(Homer Burton Adkins,1892-1949,获得美国俄亥俄州立大学的化学博士学位,曾在美国战争部门工作,并在母校、威斯康星大学、麦迪逊大学任教)申请了使用铁钼氧化物作为催化剂的专利。1944年,J Frederic Walker主编的经典作品《甲醛》发行了第一版。
分布情况
生物体
内源性氨基酸丝氨酸是天然甲醛的来源,其代谢产物为甲醛,反应方程式如下,而且产生甘氨酸,因此甲醛天然存在于生物体中。人类会迅速代谢甲醛,将其转化为甲酸,因此不会积聚在体内。动物暴露于含有同位素标记的甲醛大气中的实验表明,即使故意暴露在甲醛环境中,在非呼吸组织中发现的大多数甲醛也是源自内源性产生的甲醛。不过这并不代表甲醛对人体没有危害,一定量的甲醛还是会给人体健康造成损害。

星际
甲醛是星际介质中检测到的第一个多原子分子,同时也是第一个稳定的星际有机分子。自1969年由美国科学家在美国国家射电天文台使用直径43米的射电望远镜首次发现星际甲醛分子的6.21厘米波长的吸收谱线以来,已经在银河系的许多地区都观察到了它。
分子结构
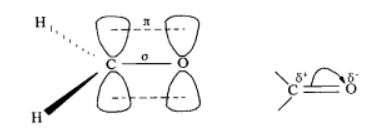
甲醛结构式中含有一个羰基,羰基由碳氧双键构成,其碳原子以三个sp²杂化轨道分别与氧和另两个氢原子形成三个σ键,这三个键在同一平面上。羰基碳原子未杂化的p轨道和氧原子中的一个p轨道彼此重叠起来,形成一个π键,与三个σ键所成的平面垂直。羰基的平面结构有利于试剂的进攻;另外,氧原子的电负性比碳原子大,π电子云偏向于氧原子,所以羰基是极性基团,这也是羰基性质活泼的原因,氧带部分负电荷,碳带部分正电荷。键角∠HCH=111.5 °,∠HCO=121.8 °。键长:碳氢键:120.3 pm、碳氧双键:110 pm。偶极矩7.56×10⁻³º D。甲醛分子结构也相当于含有两个醛基,分子中四个原子在同一个平面上。
理化性质
物理性质
纯甲醛在室温下是有刺激性的气体,沸点-21 ℃;易燃,着火温度为430 ℃;易溶于水、乙醇、二乙醚、丙酮。
甲醛水溶液是有刺激性气味的透明液体,甲醛的羰基碳原子上的电子密度是所有羰基化合物中最低的,所以甲醛在水溶液中主要以水合形式存在。
化学性质
甲醛的反应中心是官能团羰基,能够发生氧化还原反应、加成反应、缩合反应、聚合反应等。
还原反应

氧化反应



甲醛还可以将弱的氧化剂银氨络合物(氨银配合物,又称托伦试剂)还原成银,由于生成的金属银附着在容器内壁上,光亮如镜,故称为银镜反应。反应方程式如下:

歧化反应
甲醛由于没有α活泼氢,所以会在浓强碱溶液中会发生一种歧化反应,即发生分子间的氧化还原反应得到反应产物甲酸和甲醇。因为这个反应是1895年意大利化学家斯坦尼斯劳·坎尼扎罗首次发现的,所以也被称为Cannizzaro(康尼查罗)反应。

加成反应

用甲醛和乙炔加成生成1,4-丁炔二醇,再将1,4-丁炔二醇发生加氢反应生产1,4-丁二醇来制备丁二醇,俗称Reppe反应(一般译为列培反应)。


甲醛与亚硫酸钠能发生加成反应生成甲醛基酸式硫酸钠盐,由于反应中1 mol甲醛能生成1 mol的氢氧化钠,因此这个反应也是甲醛定量分析的一种依据。

甲醛还能与氨反应,生成一个特殊的化合物,这个笼状化合物被叫做乌洛托品(urotropine)或称六亚甲基四胺(hexamethylene tetramine),因为其在被硝酸硝化时会产生爆炸性极强的“旋风炸药”,因此是工业上合成炸药不可缺少的一种原料。

聚合反应
三个甲醛分子能够聚合成环状三聚甲醛:
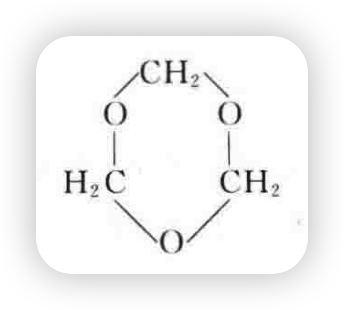
多聚甲醛在少量硫酸催化作用下加热可以发生解聚反应而放出甲醛,所以甲醛常以多聚体的形式保存,在使用时再解聚。甲醛聚合反应方程式如下:
缩合反应
甲醛和苯酚的反应是首先生成邻或对羟基苯甲醇,然后继续与苯酚和甲醛反应,最后可以反应生成酚醛树脂。酚醛树脂中加入填料等物质,经过加工后,可以得到酚醛塑料。酚醛塑料俗称电木,是电的良好绝缘体,大量用来制作各种电讯器材。

制备方法
可用于制备甲醛的原料主要为甲醇、烃类和乙醚。其中烃类直接氧化法和乙醚催化氧化法制甲醛产品收率太低,无工业化价值,工业上主要采用甲醇作为原料制备甲醛,可分为脱氢氧化法(银催化法)和甲醇氧化法(铁钼氧化物催化法)。
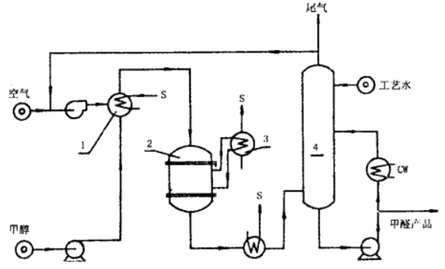
银催化法
银催化法也称采用银催化剂的“甲醇过量法”,因为是在甲醇过量的条件下(即甲醇一空气的爆炸上限以外)进行的操作。采用以浮石为载体的银做脱氢催化剂进行脱氢反应,同时又通入空气氧化,把这两个主反应结合起来,在600-700 ℃时进行。约有一半的甲醛是由氧化反应生成的。甲醇氧化时所放出的热,足以满足甲醇脱氢反应时所需的热。在生产上,开始时需要外部供给一部分热量,等反应正常进行后,就不再需要外部供热,因为,总反应是一个放热反应。在反应气体中混入了水蒸气,利用它将一部分反应热带走,并防止爆炸。
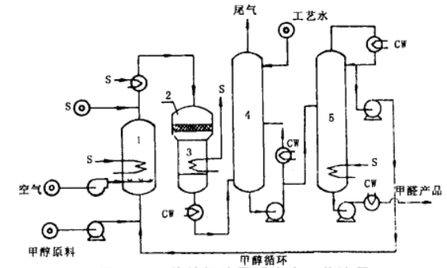

铁-钼氧化物催化法
铁-钼氧化物催化法也称采用铁钼氧化物催化剂的“空气过量法”,该反应是在常压和300~400 ℃下进行。与传统银催化氧化工艺相比,铁钼氧化物催化法中甲醛全部由甲醇的氧化放热反应制得,通过适当控制反应温度,甲醇转化率能保持99%以上,副产物除少量二氧化碳和甲酸外,主要是一氧化碳和二甲醚,甲醛产率为88~91%。
实验室制备方法
实验室可采用甲醇氧化法制取甲醛,具体做法是酒精灯加热螺旋状的铜丝至其表面为黑色,然后将铜丝放入水浴加热装有甲醇的试管,使其接近甲醇液面,待铜丝表面重新变回红色,再次加热铜丝并放入试管中,重复几次可闻到刺激性气味。
应用领域
防腐杀菌
甲醛能与蛋白质上的氨基反应,从而起到防腐杀菌的作用。35%-40%的甲醛水溶液常被称作福尔马林,可以用于浸制生物标本、给种子消毒等。2%的甲醛水溶液可用于给手术器械消毒,10%的甲醛水溶液可用于动物尸体和标本的保存。甲醛的水溶液还可以作为杀虫剂使用,直接用于处理农作物的种子和根茎,可防止黑斑病并强壮根茎。中国广东、太原等地在水稻杨花期间用甲醛水溶液喷洒田间,可使水稻增产。
作为助剂
甲醛可作为纺织、造纸、木材工业等的助剂,如在纺织业中使用甲醛,有助于保持面料上印花、染色的持久性。
制作塑料
甲醛易聚合,常温下即可生成容易纯化的三聚甲醛,工业上常用三聚甲醛生产工程塑料——聚甲醛,聚甲醛的机械强度和金属相近,具有优良的综合性能,能够替代部分金属材料,可用于制作齿轮,导轨,轴承等。
甲醛能够与苯酚、尿素等发生缩聚反应,工业上可用此性质生产酚醛塑料和氨基塑料。酚醛塑料是一种热固性塑料,其主要成分酚醛树脂可通过甲醛和苯酚缩聚制得,具有机械强度高、耐磨、耐热、耐燃、绝缘性能好、便宜等优点,被广泛应用于制造绝缘材料、电器元件、日用品等。氨基塑料主要成分是氨基树脂,应用最多的氨基树脂是脲醛树脂,可以通过甲醛与氨基酸缩聚制得,脲醛塑料无臭无味、耐油并且价格便宜,常用于制作日用品和装饰品、粘合剂、涂料等。
六亚甲基四胺
六亚甲基四胺又名乌洛托品,可以通过福尔马林和氨水反应制得,其无毒、无臭,对皮肤有刺激作用,是一种重要的化工原料,被广泛应用于医药、塑料、橡胶工业,如制作电玉粉的固化剂、黑索金炸药、橡胶的硫化促进剂等。
合成纤维
甲醛在合成纤维工业中常用于维尼纶生产的后处理工序,聚乙烯醇纤维具有较好的强度、弹性、拉长率等,但是耐热水性较差,其与甲醛进行缩醛化反应后可以减少高分子聚合物中的羧基,能够有效提高其耐热水性。
医药
安全事宜
消防事宜
纯甲醛的爆炸范围为7~73%,其下限为7%。甲醛蒸气还能与空气形成爆炸性混合物。纯甲醛的闪点为85 ℃(闭杯/气体);37.2%甲醛水溶液(醇含量为4.1%)的闪点为75 ℃。甲醛在空气中的自燃点为430 ℃,若遇高热,有爆炸的危险。
健康危害
甲醛有毒性,空气中的甲醛含量达0.01-2 ppm,会刺激到人眼;0.10-11 ppm,会对上呼吸道造成刺激;5-30 ppm,可能会出现咳嗽、胸闷等症状;50-100 ppm,可能会导致肺水肿、炎症、肺炎等;大于100 ppm能够致死。
甲醛也是生物体的代谢中间产物,不过内源性甲醛可与DNA结合,导致基因突变或染色体变异。比如,当小鼠的甲醛代谢相关基因ADH5和FANCD2同时去除时,其内源性甲醛可大量积累,诱发血细胞和骨髓细胞降低,大大降低其存活率。
甲醛还有致癌性,基于甲醛暴露量与鼻咽癌、白血病疾病的发生关系的调查,国际癌症研究机构(IARC)将甲醛归类为1类致癌物,不过当平均甲醛浓度低于1 ppm且短期甲醛浓度低于4 ppm时,人体患癌症的相对风险不会增加。
甲醛检测标准
对民用建筑住宅,需要达到的竣工验收标准规范为:甲醛浓度小于等于0.08 mg/m³(采用集中空调的民用建筑,应在空调正常运转的条件下进行;采用自然通风的,在对外门窗关闭1小时后)。
中国发布的国家标准《居室空气中甲醛的卫生标准》中明确表示,居室内空气中甲醛卫生标准规定为0.08 mg/m³。
由于甲醛对人体有一定的危害性,因此对甲醛进行检测并控制其浓度极为重要,现在检测甲醛的方法主要有以下三种。
分光光度法
电化学法
电化学法是根据化学反应所产生的电流、电量、电位的变化来测定反应物浓度进行定量分析的方法,常用的甲醛电化学检测方法主要有示波极谱法和电位法。电化学法的缺点是所受干扰物质多、重复性差。
色谱法
色谱法是一种常见的甲醛检测的仪器方法,特点是灵敏度高,不易受干扰,主要有三种:离子色谱法,不需要化学试剂、选择性好、灵敏度高、分析准确;气相色谱法,无干扰、灵敏准确,但是衍生的硫化物和其他同分异构体难区分;液相色谱法,分离效果好且回收率高,但是以其价格贵。
荧光法
采用乙酰丙酮应荧光法能够测定微量甲醛,其做法是将甲醛样本与乙酰丙酮溶液混合稀释,在经紫外光照射后,能够反射出荧光,经定量分析可以测定甲醛的浓度。该方法操作简单、能够快速检出甲醛。
去除方法
物理吸附法
物理吸附法除甲醛,常用的有活性炭、沸石、金属有机物框架材料(MOFs)等,它们均具有很好的吸附能力,使用起来经济方便,不过甲醛只是从空气中转移到了吸附剂中,没有后续的分解步骤,需要对吸附剂进行定期更新、维护。
光催化氧化法
微生物降解法
某些微生物能够以甲醛为食,并将其转化为水和二氧化碳等简单无害的物质。微生物降解法的优点是致力效果好、成本低、绿色环保无二次污染等,缺点则是菌种选择困难,对环境的要求比较高且净化的效率比较慢。


