电负性(化合物中原子吸引电子的能力)

VLoG
次浏览
更新时间:2023-05-23
电负性
化合物中原子吸引电子的能力
概述
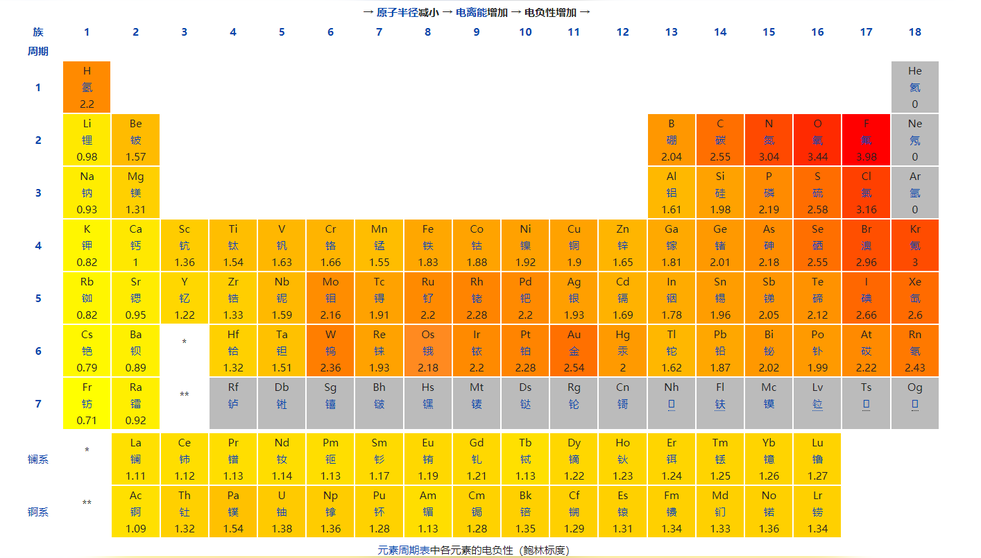
电负性是原子在化合物中吸引电子能力的标度。1932年,莱纳斯·卡尔·鲍林首先提出了电负性的概念,用来表示两个不同原子间形成化学键时吸引电子能力的相对强弱。元素电负性数值越大,表示其原子在化合物中吸引电子的能力越强;反之,电负性数值越小,相应原子在化合物中吸引电子的能力越弱。
计算方法
电负性是相对值,没有单位。电负性的计算方法有多种,每种方法的电负性数值都有所不同,所以利用电负性数值时,必须是同一套数值进行比较。比较有代表性的电负性计算方法有以下几种:
1)1932年L.C.鲍林提出的公式
鲍林的计算方法是:

其中, 、
、 、
、 分别指
分别指 ,AB,
,AB, 分子的键能。
分子的键能。





2)1934年R.S.密立根的公式

式中,I为电离能,A为电子亲和能,注:放热为正,吸热为负。
3)1956年A.L.阿莱和E.罗周的公式
即

其中 为有效核电荷数,r为半径。
为有效核电荷数,r为半径。

4)1989年L.C.Allen的公式
式中,m和n分别为p轨道和s轨道上的电子数, 分别为s轨道和p轨道上的电子平均能量。
分别为s轨道和p轨道上的电子平均能量。

常见变化
非金属系: 。
。

金属系: 。
。

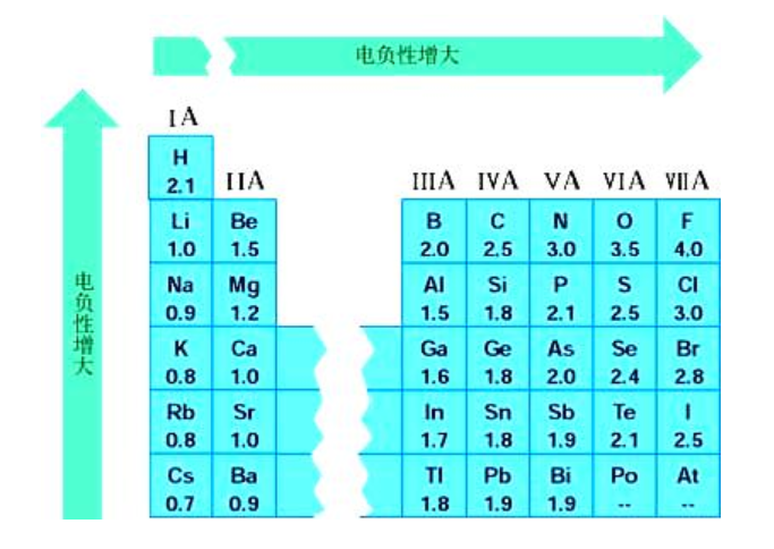
周期变化
氢 2.1 锂1.0 铍 1.57 硼 2.04 碳 2.55 氮 3.04 氧 3.44 氟 3.98;
钠 0.93 镁 1.31 铝 1.61 硅 1.90 磷 2.19 硫 2.58 氯 3.16;
钾 0.82 钙 1.00 锰 1.55 铁 1.83 镍 1.91 铜 1.9 锌 1.65 镓 1.81 锗 2.01 砷 2.18 硒 2.48 溴 2.96;
铷 0.82 锶 0.95 银 1.93 碘 2.66 钡 0.89 金 2.54 铅 2.33。
电负性也可以作为判断元素的金属性和非金属性强弱的尺度。一般来说,电负性大于1.8的是非金属元素,小于1.8的是金属元素,而位于非金属三角区边界的“类金属”(如锗、锑等)的电负性则在1.8左右,它们既有金属性又有非金属性。
递变规律
应用
参考资料
[1]
杨思娅 . 无机化学教学中的电负性应用 : 曲靖师专学报 ,1989-03