化合价(元素形成化合物时表现出来的性质)

VLoG
次浏览
更新时间:2023-05-23
化合价
元素形成化合物时表现出来的性质
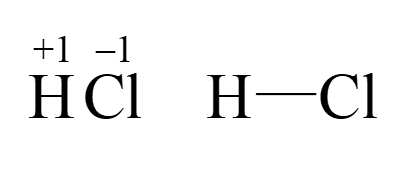
化合价(英文:valence或 valency),是元素的一种重要性质,与原子层结构密切相关。化合价决定了该元素的原子可以与该元素结合的其他原子的数量。
基本信息
中文名
化合价
英文名
valence,valency
提出时间
1868年
相关人物
维克尔豪斯
研究对象
物质结构与作用力
运用领域
化学
化合价概念的提出经过了一系列的历史演变,随着价键理论等相关研究的深入,逐渐分裂出共价、离子价、配位数、氧化数或氧化态等诸多概念。
化合价是研究分子结构的核心概念,它对认识物质结构、化学反应和化学反应发生的条件等都具有重要的意义。
历史由来
经典化合价概念的发展
1852年,英国化学家爱德华·弗兰克兰( Edward Frankland)在实验中发现不同金属与化合物间的“结合能力”有所区别。他首先提出:元素在生成化合物时尽管不同原子的性质差别较大,但总要求结合一定数量的某种原子,例如二乙基锡仅与一个氧原子结合,而单质锡与氧至少存在两种化合方式。他将这种性质称为元素的“化合力”。
布朗的构造式
弗兰克兰提出“化合力”的概念后并没有为人所接受。1857年,德国化学家凯库勒(Friedrich August Kekulé)和英国化学家库帕(Archibald Scott Couper)独立发展了弗兰克兰的观点,他们使用“原子数”(atomicity)或“亲合力单位”(affinity unit)来更清晰地表示“化合力”的概念。例如,氢元素最多仅与一个原子,因此氢的亲合力单位为1,而碳元素总与四个“一原子性”元素的原子结合,因而碳的亲合力单位为4,并且各种元素在不同化合物中总是倾向于遵循亲合力单位数等价。1858 年,库帕使用了一种用虚线连接原子的图解式来描述其提出的概念。这种方式不是类型式,和分子构造有关。
库帕的图解式
1864年,德国化学家迈尔(Julius Lothar Meyer)发展了凯库勒和库帕的理论,形成原子价学说。他首次使用原子价或化合价(Valence)这一术语来代替“原子数”和“亲合力单位”。按照原子价学说,氢原子的原子价永远是1价,其他原子可根据与氢原子的结合情况来确定。原子价学说以及“Valence”这一术语得到了普遍承认和应用。同年,苏格兰化学家布朗(A.C.Brown)提出了一种用于表示化合物化学特征的构造式。
1868年,德国化学家维克尔豪斯(Wickelhous)把这些不同术语统一起来,简化为现代所沿用的“价”( Valence)的概念。“价”可以表征为原子价( 对于原子 )和化合价(对于原子和原子团)。
1914一1919 年,美国化学家路易斯(Gilbert Newton Lewis)、德国化学家柯塞尔(Albrecht Kossel)、美国化学家朗缪尔(Irving Langmuir)和英国科学家西奇威克(Henry Sidgwick)等先后创立和发展了原子价的电子理论,将原子价划分为共价和电价,指出了原子间的相互作用是价电子和各原子核的相互作用。
基于现代价键理论的化合价概念的建立
随着19世纪初电价和共价理论的建立,经典的价键理论日趋成熟。经典的价键理论是基于牛顿力学框架对电子运动的描述,仍停留在定性层面。1927 年,英国化学家海特勒海特勒(Walter Heinrich Heitler)和德国化学家伦敦(Fritz London)第一次使用量子力学来研究化学领域问题,指出了化学键有共价键、离子键、配位键、金属键 4 种,这是现代的化学键理论的开端。1931年,美国化学家鲍林(Linus Pauling)进一步推广了海特勒和伦敦的研究,形成了现代价键理论,自此对电子运动的描述上升到定量计算的水平。1932年,美国化学家密里肯(Robert Sanderson Mulliken)等人从分子整体出发来说明化学键的形成,建立了分子轨道理论。1952年,英国化学家欧格尔(Leslie Orgel)将分子轨道理论和晶体场理论结合起米,提出了配位场理论。价键理论、分子轨道理论和配位场理论等三大理论基础的形成标志着现代价键理论的逐渐完善,人类对化学键的认识也深入到电子水平。
基本概念
定义
化合价也称为原子价,是元素的一种重要性质。它指的是某个原子(或原子团)与其他原子(或原子团)化合时的成键能力,决定了该元素的原子可以与该元素结合的其他原子的数量。在数值上,化合价等于原子间得失的电子数或者偏移的共用电子对数。化合价有正有负,表示原子的电子得失或者共用电子对的偏移。例如,水的分子式为H2O,其中氧原子的化合价为-2,氢原子的化合价为+1价。
除了单个原子外,在一些化合物中,存在着一些带电的原子团,它们在与其它化合物反应时常作为一个整体,这种原子团,也称为根。例如,氯化铵的化学式为NH4Cl,它由一个铵根离子NH4和氯离子Cl结合而成。其中氨根离子的化合价为+1价,氯原子的化合价为-1价。
除了描述原子与不同元素原子结合的情况外,化合价还泛指分子中原子间的相互作用,因此化合价与化学键理论密切相关。化合价是研究分子结构的核心概念,它对认识物质结构、化学反应和化学反应发生的条件等都具有重要的意义。
分类
化合价的本质是核外价电子的结合,从而达到原子核外最外层2电子或8电子的稳定结构。由于某原子的化合价只有在其与其他元素的原子结合时才能体现,因此在单质中,元素的化合价为零。在不同种类的化合物中,这种结合方式有所不同,化合价的定义也有所区别。
共价化合物
共价化合物中,原子间是通过各提供一个电子形成共用电子的方式结合的,把化学键数和化合价联系起来,化合价也称为共价。某个原子的化合价(共价)在数值上等于该原子与其他原子形成的共用电子对数,其正负由电子对的偏移决定。电子对偏向该原子,其化合价为负价,电子对偏离该原子,其化合价为正价。例如,水分子H2O中,氧原子与每个氢原子各形成一对共用电子对,氧原子有两对共用电子对,电子对偏向氧原子,因此水分子中的氧化合价为-2价;每个氢原子有一对共用电子对,电子对偏离氢原子,因此水分子中的氢原子的化合价为+1价。
离子化合物
在离子化合物中,原子间存在着电子得失形成离子。离子的电荷数可看成离子的化合价,化合价也称离子价或电价。离子化合物中某个原子的化合价在数值上等于其得失电子数,其正负取决该原子得到或失去电子,原子得到电子,其化合价为负价;原子失去电子,其化合价为正价。例如,氯化钠为离子化合物,其分子式为NaCl,其中钠原子失去了一个电子,化合价为+1价,氯原子得到一个电子,其化合价为-1价。
配位化合物
在部分共价化合物中,存在着共用电子对的两个电子均由一个有孤对电子的原子提供,而另一个原子提供空轨道的情况,这种成键类型被称为配位键,对应的化合物被称为配位化合物,简称配合物或者络合物,此时其化合价也称为配价。需要指出的是,由于配位键不存在电子的得失或者电子对的偏移,因此对应的元素不存在化合价的变化。例如,在CuSO4溶液中加入过量NH3,会形成[Cu(NH3)4]的配合物,实质上该配合物是由Cu和4个NH3分子以配位键的形式结合,结合后Cu原子仍显+2价,NH3分子整体仍为0价。
推断方法
规律
在实际运用中,可以根据物质化学式推求元素化合价,也可以根据元素化合价推求物质化学式,具体有以下规律和原则。化合价和化学式之间有密切的联系。知道了元素的化合价,可以根据成分元素的化合价推求实际存在的化合物中元素原子的个数比,从而写出化合物的化学式。
- 化合价通常为整数。
- 金属元素通常显正价,非金属元素通常显负价。
- 有些元素可以显多种化合价,例如铁有+2价和+3价。
- 化合价的正负表示的是携带正(负)电荷数,无代数上的大小区分。
- 单质中元素的化合价为零,化合物中所有原子的化合价代数为零。
- 离子化合物中元素的化合价(电价)在数值上等于化合物中离子所带的电荷数。
- 共价化合物中元素的化合价(共价)是指与共价键相对应的化合价,即由元素的原子间共用电子对而成的化合价。在数值上等于原子间的共用电子对数。
- 非金属元素与金属素化合时通常显负价,与氧元素化合时通常显正价。
- 化合价与该元素的原子结构密切相关,一般由最外层(可能包括次外层)电子数决定。通常,金属的化合价一般等于原子最外层电子数,非金属的最高正价通常也等于原子最外层电子数,且非金属原子的负价与最高正价的绝对值之和为8。
- 原子团的化合价也叫根价,在数值上与这个原子团所带的电荷数相等。
示例
- 碘酸钾的化学式为KIO3,求碘元素的化合价。
根据化合价推断的规律,钾元素为+1价,氧元素为-2价,假设碘元素的化合价为x,根据化合物中所有原子的化合价代数为零,可得:

解得碘元素的化合价为+5。
- 已知某种磷的氧化物中磷为+5价,氧为-2价,写出这种磷的氧化物的化学式。
假设这种氧化物的化学式为PxOy根据化合物中所有原子的化合价代数为零,可得:

解得

表示方法
化学式
在化学式中,元素的化合价应写在元素符号的正上方,另外要注意化合价表示为+n或-n,正负号在前不能成n十,“1”不能省略,例如,氯化镁中的镁元素为+2价,应该标记为:

离子符号 | 化合价 | |
位置 | 元素符号的右上角 | 元素符号的正上方 |
正、负号 | 在数字后 | 在数字前 |
数值 | 在正、负号之前,"1"要省略 | 在正、负号之后,"1"不能省略 |
实例 |  |  |
化合价与离子符号的书写区分,资料来源于 | ||
结构式
在化合物的结构式中,某个原子的化合价的绝对值等于与其相连的化学键总数。例如,水分子结构式为

常见元素的化合价
名称 | 符号 | 常见的化合价 | 名称 | 符号 | 常见的化合价 |
钾 | K | +1 | 氟 | CI | -1、+1、+5、+7 |
钠 | Na | +1 | 溴 | Br | -1 |
银 | Ag | +1 | 氧 | O | -2 |
钙 | Ca | +2 | 硫 | S | -2、44、+6 |
镁 | Mg | +2 | 碳 | C | +2、+4 |
钡 | Ba | +2 | 硅 | Si | +4 |
铜 | Cu | +1、+2 | 氮 | N | -3、+2、+3、+4、+5 |
铁 | Fe | +2、+3 | 磷 | P | -3、+3、+5 |
铝 | AI | +3 | 氯氧根 | OH | -1 |
锰 | Mn | +2、+4、+6、+7 | 硝酸根 | NO3 | -1 |
锌 | Zn | +2 | 硫酸根 | SO4 | -2 |
氢 | H | +1 | 碳酸根 | CO3 | -2 |
氟 | F | -1 | 铵根 | NH4 | +1 |
常见元素的化合价,资料来源于 | |||||
氧化数
氧化数又称为氧化态,是物质中原子氧化程度的量度。氧化数是人为性、经验性的概念,是按照一定规则和经验人为指定的一个数值,用来表征元素在化合物中的形式电荷,主要用于氧化还原反应的相关问题中,例如定义氧化剂、还原剂及氧化还原反应,配平氧化还原反应方程式,计算氧化还原当量,相较于化合价的概念更加直观简单。
与化合价只能为整数不同,氧化数可以为分数。例如,四氧化三铁的化学式为Fe3O4,其中铁的氧化数为8/3。事实上,四氧化三铁为一种混合氧化物,其化学式可改写为:Fe2O3·FeO。此外,在超氧化物中,氧原子的氧化数为-1/2等。
需要指出的是,在中学阶段,由于没有引入“氧化数”的概念,在定义氧化还原反应时将其描述为“化合价存在变化”是不严谨的,应使用“氧化数”来替代“化合价”。此外,一般所说的某元素的正、负化合价,除了是电价与氧化数一致以外,实际上指的也是氧化数。


