最外层电子数(决定元素化学性质的重要依据)

VLoG
次浏览
更新时间:2023-05-22
最外层电子数
决定元素化学性质的重要依据
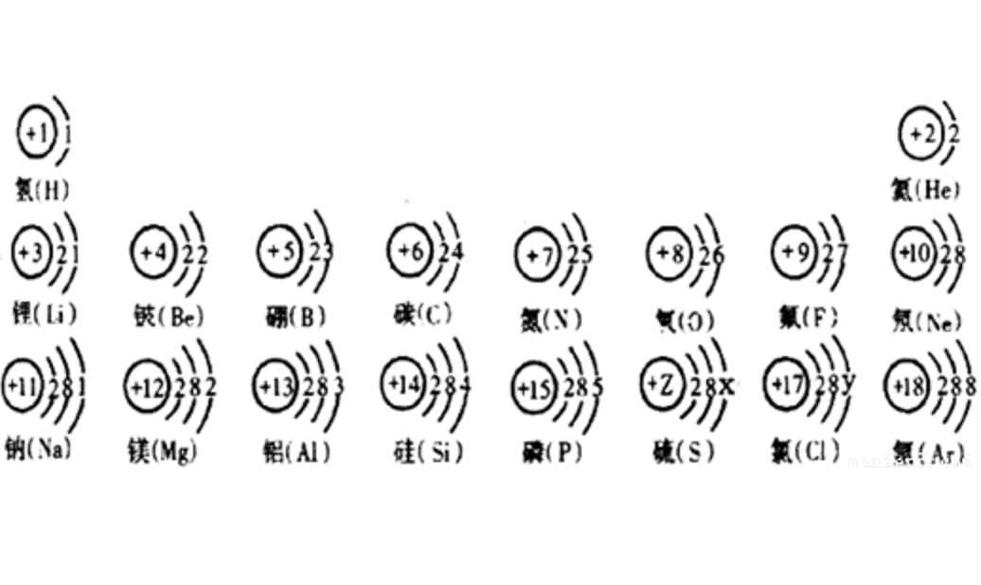
最外层电子数是决定元素化学性质的重要依据。
基本信息
| 外文名 | number of valence electrons |
| 作用 | 决定元素化学性质 |
| 理论依据 | 族数=最外层电子数(He除外) |
| 常规状态 | 原子电子层最外层电子为4时 |
研究目的
电子数规律
原因
由于能级交错的原因,End>E(n+1)s。当ns和np充满时(共4个轨道,最多容纳8个电子),多余电子不是填入nd,而是首先形成新电子层,填入(n+1)s轨道中,因此最外层电子数不可能超过8个。
同理可以解释为什么次外层电子数不超过18个。若最外层是第n层,次外层就是第(n-1)层。由于E(n-1)f>E(n+1)s>Enp,在第(n+1)层出现前,次外层只有(n-1)s、(n-1)p、(n-1)d上有电子,这三个亚层共有9个轨道,最多可容纳18个电子,因此次外层电子数不超过18个。例如,原子最外层是第五层,次外层就是第四层,由于E4f>E6s>E5p,当第六层出现之前,次外层(第四层)只有在4s、4p和4d轨道上有电子,这三个亚层共有9个轨道,最多可容纳18个电子,也就是次外层不超过18个电子。


