离子键(作用力强、无饱和性的化学键)

VLoG
次浏览
更新时间:2023-05-23
离子键
本词条是多义词,共2个义项
作用力强、无饱和性的化学键
基本信息
| 中文名 | 离子键 |
| 外文名 | Ionic bond |
| 别名 | 电价键 盐键 |
| 影响因素 | 半径、电荷数 |
| 实质 | 静电作用 |
| 特点 | 作用力强,无饱和性,无方向性 |
收起
简介
离子键,又被称为盐键或电价键,是化学键的一种,通过两个或多个原子或化学集团失去或获得电子而成为离子后形成。带相反电荷的离子之间存在静电作用,当两个带相反电荷的离子靠近时,表现为相互吸引,而电子和电子、原子核与原子核之间又存在着静电排斥作用,当静电吸引与静电排斥作用达到平衡时,便形成离子键。因此,离子键是阳离子和阴离子之间由于静电作用所形成的化学键。
此类化学键往往在金属与非金属间形成。失去电子的往往是金属元素的原子,而获得电子的往往是非金属元素的原子。通常,活泼金属与活泼非金属形成离子键,如钾、钠、钙等金属和氯、溴等非金属化合时,都能形成离子键。
成键微粒:阴离子和阳离子;
键的本质:阴离子和阳离子之间的静电作用;
影响因素:阴阳离子的半径的大小半径越大离子键越小;阴阳离子电荷的多少;
电子式:在元素符号周围用“· ”或“×”来表示原子最外层电子的式子。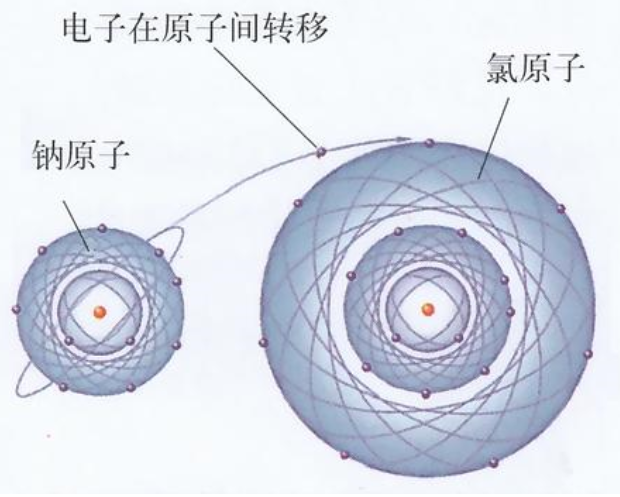

离子键
形成
研究认为,在分子或晶体中的原子决不是简单地堆砌在一起,而是存在着强烈的相互作用。化学上把这种分子或晶体中原子间(有时原子得失电子转变成离子)的强烈作用力叫做化学键。键的实质是一种力。所以有的又叫键力,或就叫键。
离子既可以是单离子,如Na、Cl;也可以由原子团形成;如,等。它往往在金属与非金属间形成。失去电子的往往是金属元素的原子,而获得电子的往往是非金属元素的原子。通常,活泼金属与活泼非离子键的形成示意图金属形成离子键,如钾、钠、钙等金属和氯、溴等非金属化合时,都能形成离子键。且仅当总体的能级下降的时候,反应才会发生(由化学键联接的原子较自由原子有着较低的能级)。下降越多,形成的键越强。
而在现实中,原子间并不形成“纯”离子键。所有的键都或多或少带有共价键的成分。成键原子之间电平均程度越高,离子键成分越低。
离子键的结合力很大,因此离子晶体的硬度高,强度大,热膨胀系数小,但脆性大。离子键种很难产生可以自由运动的电子,所以离子晶体都是良好的绝缘体。在离子键结合中,由于离子的外层电子比较牢固的被束缚,可见光的能量一般不足以使其受激发,因而不吸收可见光,所以典型的离子晶体是无色透明的。Al2O3、MgO、TiO2、NaCl等化合物都是离子键。
当元素周期表中相隔较远的正电性元素原子和负电性元素原子接触时,前者失去最外层价电子变成带正电荷离子键的形成的正离子,后者获得电子变成带负电荷的满壳层负离子。正离子和负离子由静电引力相互吸引;同时当它们十分接近时发生排斥,引力和斥力相等即形成稳定的离子键。
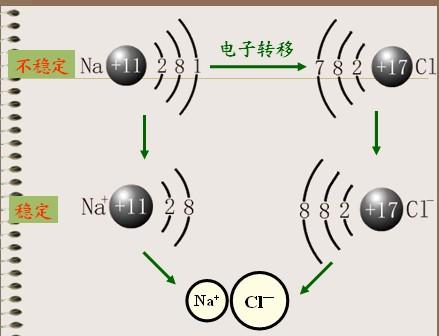
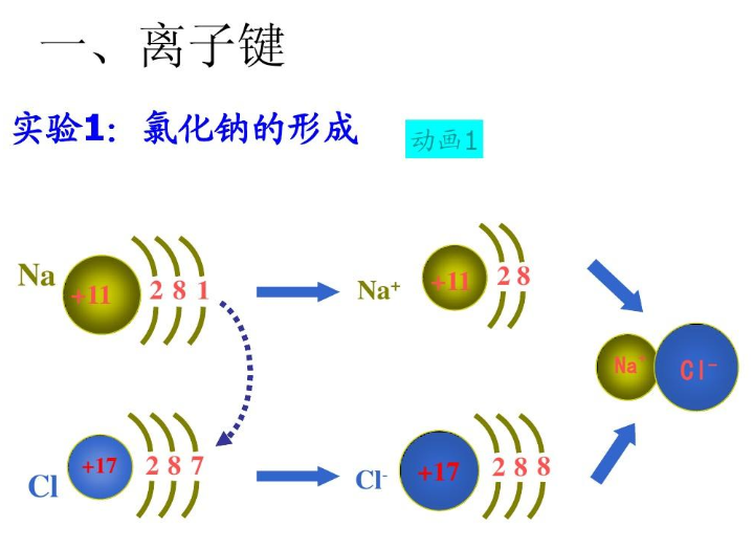
从原子结构看,钠原子最外电子层上有1个电子,容易失去;氯原子在外电子层有7个电子容易得到一个电子。当钠原子与氯原子相遇时,钠原子失去最外层的一个电子,成为钠离子,带正电,氯原子得到钠失去的电子,成为带负电的氯离子,阴阳离子的异性电荷的吸引作用,与原子核之间、电子之间的排斥作用达到平衡,形成了稳定的离子键。
成键微粒
阴离子和阳离子
键的本质
阴离子和阳离子之间的静电作用
影响因素
阴阳离子的半径的大小;阴阳离子电荷的多少
电子式
在元素符号周围用“·”或“×”来表示原子最外层电子的式子
性质
离子键的作用力强,无饱和性,无方向性。
离子键存在于离子化合物中,离子化合物在室温下是以晶体形式存在。
离子键较氢键强,其强度与共价键接近。
阴阳离子是否中和
相关视频
全部
7593次播放06:51
高中化学必修二重点知识导入4:离子键