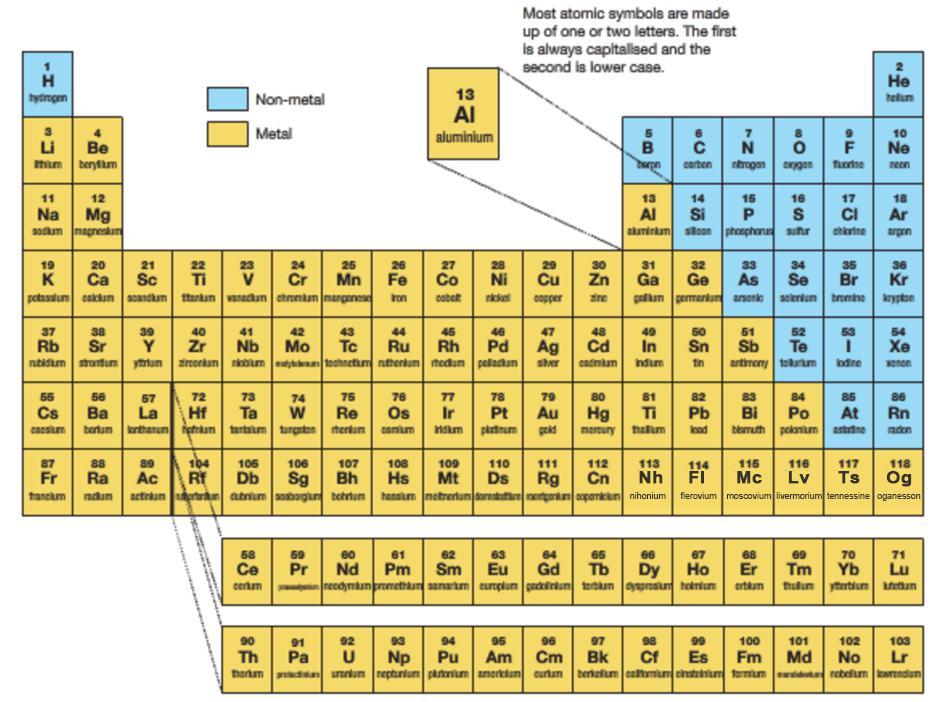
元素周期表(俄罗斯化学家门捷列夫总结的化学元素列表)

VLoG
次浏览
更新时间:2023-05-22
元素周期表
本词条是多义词,共3个义项
俄罗斯化学家门捷列夫总结的化学元素列表
化学元素周期表是根据原子序数从小至大排序的化学元素列表。列表大体呈长方形,某些元素周期中留有空格,使特性相近的元素归在同一族中,如碱金属元素、碱土金属、卤族元素、稀有气体等。这使周期表中形成元素分区且分有七主族、七副族、Ⅷ族、18族。由于周期表能够准确地预测各种元素的特性及其之间的关系,因此它在化学及其他科学范畴中被广泛使用,作为分析化学行为时十分有用的框架。
俄国化学家门捷列夫(Dmitri Mendeleev)于1869年发明此周期表(第一代元素周期表),此后不断有人提出各种类型周期表不下170余种,归纳起来主要有:短式表(以门捷列夫为代表)、长式表(维尔纳式为代表)、特长表(以波尔塔式为代表);平面螺线表和圆形表(以达姆开夫式为代表);立体周期表(以莱西的圆锥柱立体表为代表)等众多类型表。
注:中国教学上长期使用的是长式周期表,即维尔纳式为代表。
基本信息
| 中文名 | 元素周期表 |
| 别名 | 元素表 |
| 外文名 | periodic table of elements |
| 创造者 | |
| 所属学科 | 化学 |
| 发明时间 | 1869年 |
| 元素分区 | 七主族、七副族、Ⅷ族、18族 |
| 其他类型 | 短式表、长式表、特长表等 |
收起
发展历程
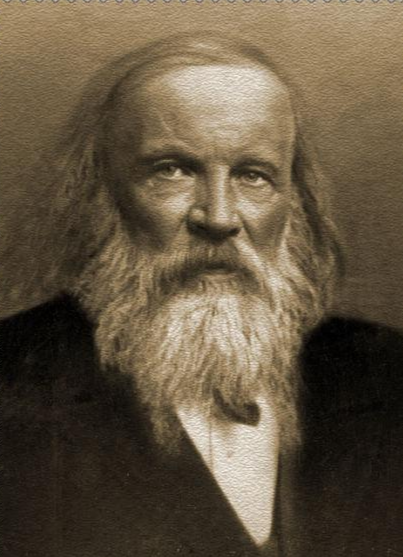
德米特里·伊万诺维奇·门捷列夫
原子半径由左到右依次减小,上到下依次增大。
在化学教科书和字典中,都附有一张“元素周期表(英文:the periodic table)”。这张表揭示了物质世界的秘密,把一些看来似乎互不相关的元素统一起来,组成了一个完整的自然体系。它的发明,是近代化学史上的一个创举,对于促进化学的发展,起了巨大的作用。看到这张表,人们便会想到它的最早发明者——门捷列夫。1869年,俄国化学家门捷列夫按照相对原子质量由小到大排列,将化学性质相似的元素放在同一纵行,编制出第一张元素周期表。元素周期表揭示了化学元素之间的内在联系,使其构成了一个完整的体系,成为化学发展史上的重要里程碑之一。随着科学的发展,元素周期表中未知元素留下的空位先后被填满。当原子结构的奥秘被发现时,编排依据由相对原子质量改为原子的质子数﹙核外电子数或核电荷数﹚,形成现行的元素周期表。
质子数=原子序数=核外电子数=核电荷数
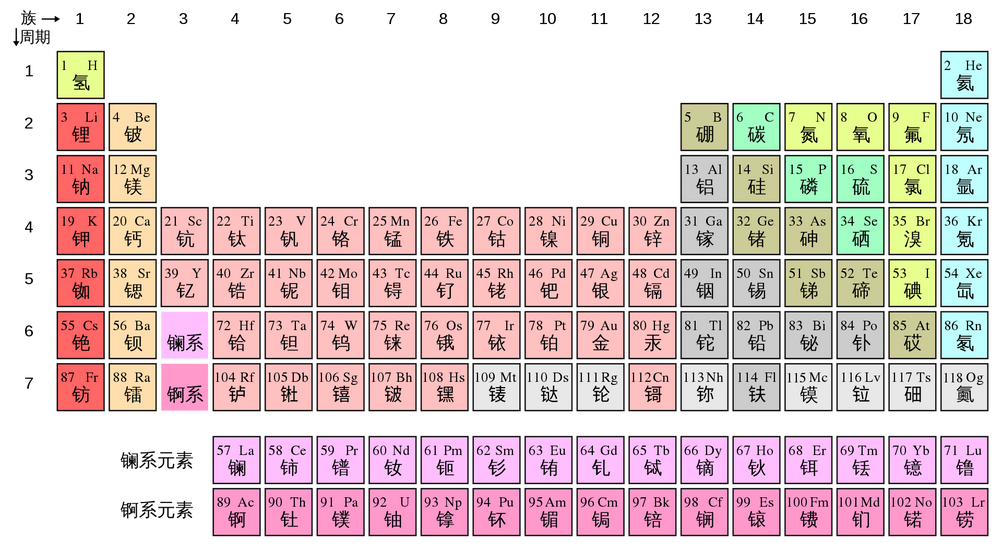
元素周期表
元素周期表有7个周期,16个族。每一个横行叫作一个周期,每一个纵行叫作一个族(VIII族包含三个纵列)。这7个周期又可分成短周期 、长周期
、长周期 。共有16个族,从左到右每个纵列算一族(VIII族除外)。例如:氢属于I A族元素,而氦属于0族元素。
。共有16个族,从左到右每个纵列算一族(VIII族除外)。例如:氢属于I A族元素,而氦属于0族元素。


元素在周期表中的位置不仅反映了元素的原子结构,也显示了元素性质的递变规律和元素之间的内在联系。使其构成了一个完整的体系,被称为化学发展的重要里程碑之一。
同一周期内,从左到右,元素核外电子层数相同,最外层电子数依次递增,原子半径递减(零族元素除外)。失电子能力逐渐减弱,获电子能力逐渐增强,金属性逐渐减弱,非金属性逐渐增强。元素的最高正氧化数从左到右递增(没有正价的除外),最低负氧化数从左到右递增(第一周期除外,第二周期的O、F元素除外)。
同一族中,由上而下,最外层电子数相同,核外电子层数逐渐增多,原子半径增大,原子序数递增,元素金属性递增,非金属性递减。
元素周期表的意义重大,科学家正是用此来寻找新型元素及化合物。
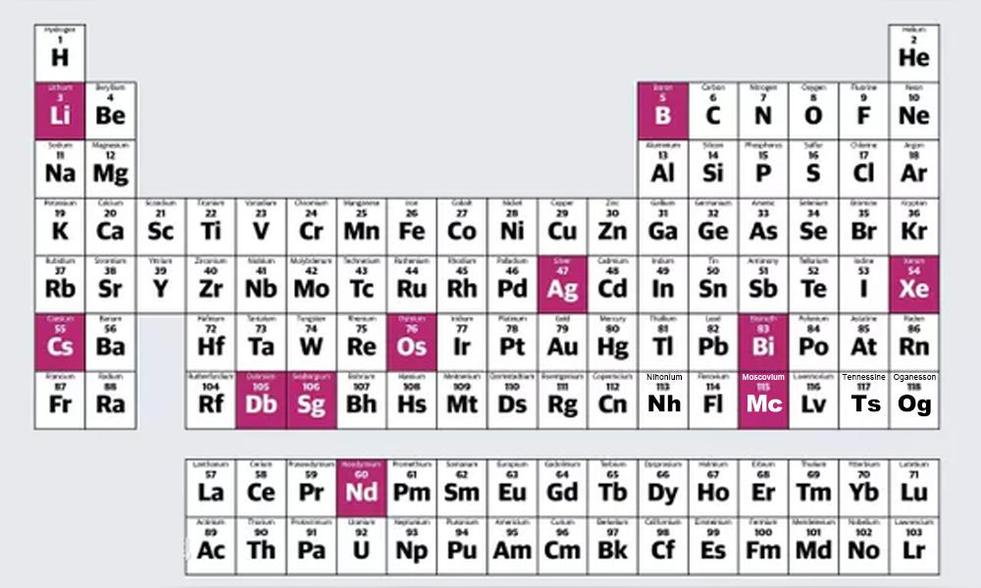
元素符号周期表
2015年12月30日,国际纯粹与应用化学联合会宣布第113,115,117,118号元素存在,它们将由日本、俄罗斯和美国科学家命名。IUPAC官方宣布,元素周期表已经加入4个新元素。
2016年6月8日,国际纯粹与应用化学联合会宣布,将合成化学元素第113号(缩写为Nh)、115号(Mc)、117号(Ts)和118号(Og)提名为化学新元素。
2017年5月9日,中国科学院、国家语言文字工作委员会、全国科学技术名词审定委员会在北京联合举行新闻发布会,正式向社会发布113号、115号、117号、118号元素中文名称。这4个元素的中文发音依次为“nǐ”“mò”“tián” “ào”。
2021年05月,铅元素标准原子量修改,元素周期表更新。
内容
展开表格
镧系和锕系元素
镧系 | La 镧 | Ce 铈 | Pr 镨 | Nd 钕 | Pm 钷 | Sm 钐 | Eu 铕 | Gd 钆 | Tb 铽 | Dy 镝 | Ho 钬 | Er 铒 | Tm 铥 | Yb 镱 | Lu 镥 |
锕系 | Ac 锕 | Th 钍 | Pa 镤 | U 铀 | Np 镎 | Pu 钚 | Am 镅 | Cm 锔 | Bk 锫 | Cf 锎 | Es 锿 | Fm 镄 | Md 钔 | No 锘 | Lr 铹 |
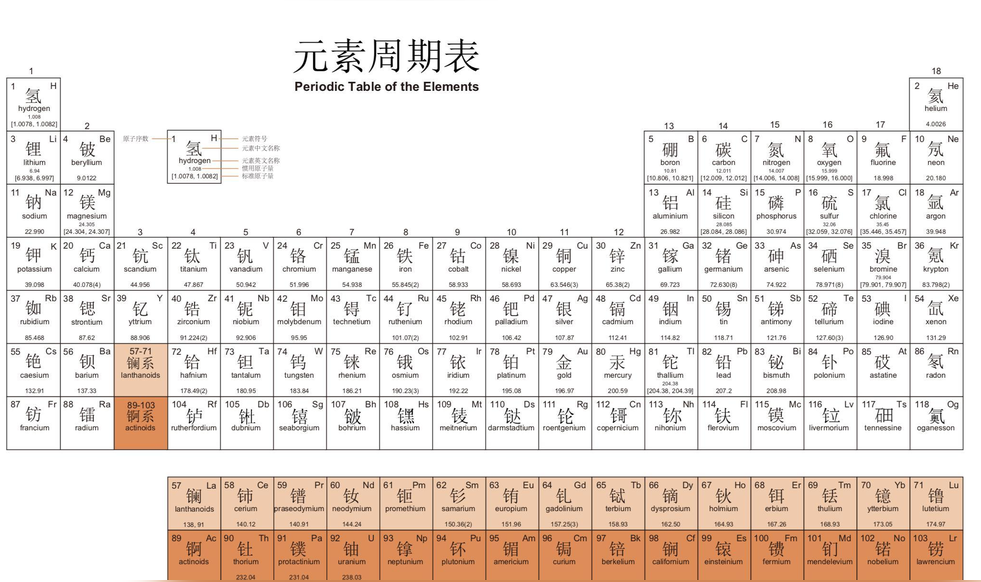
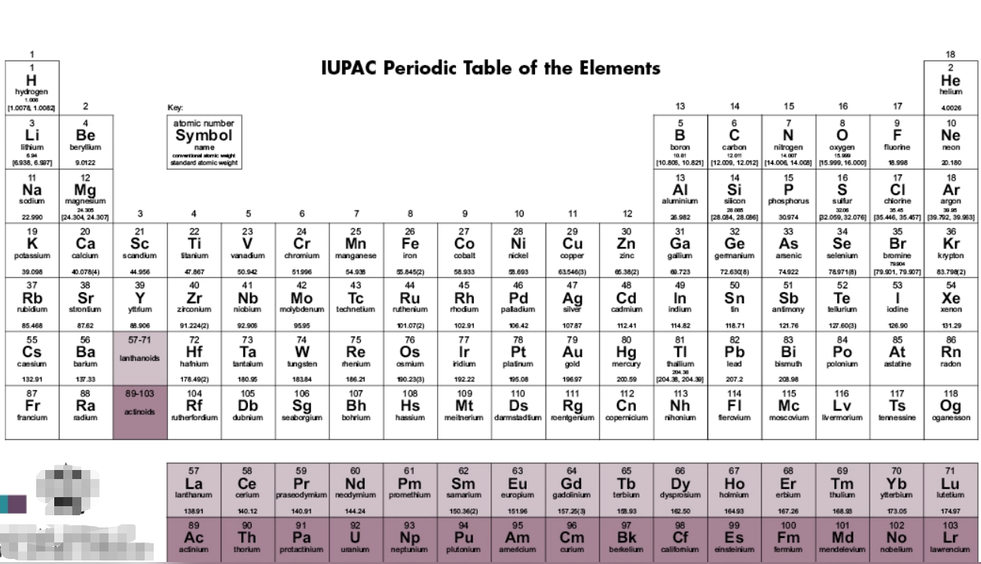
IUPAC化学元素周期表(中文版)
(U+2CB3B)、(U+2CB4A)、(U+2CB73)、(U+2CB5B)、(U+2CB76)、鿏(U+9FCF)、(U+2B7FC)、(U+2CB2D)、鿔(U+9FD4)、鿭(U+9FED)、(U+2B4E7)、(U+2B7F7)、鿬(U+9FEC)、鿫(U+9FEB)。
元素列表
基本物理性质
ⅠA族(碱金属)
碱金属单质 | 颜色和状态 | 密度(×10³kg/m³) | 熔点(℃) | 沸点(℃) |
氢(不属于碱金属) | 无色,气体 | 0.0000899 | -259.125 | -258.882 |
锂 | 银白色,柔软 | 0.534 | 180.5 | 1347 |
钠 | 银白色,柔软 | 0.97 | 97.81 | 882.9 |
钾 | 银白色,柔软 | 0.86 | 63.65 | 774 |
铷 | 银白色,柔软 | 1.532 | 38.89 | 688 |
展开表格
1.还原性;Li
2.氧化性:Li>Na>K>Rb>Cs
3.碱金属元素能与水或氧气反应生成碱或碱性氧化物
4.氢本来不是碱金属,但因为在IA族,所以归入此表
ⅡA族(碱土金属)
碱土金属单质 | 颜色和状态 | 密度(×10³kg/m³) | 熔点(℃) | 沸点(℃) |
铍 | 钢灰色,较硬 | 1.848 | 1278 | 2970(加压) |
镁 | 银白色,柔软 | 1.738 | 648.9 | 1090 |
钙 | 银白色,柔软 | 1.550 | 839 | 1484 |
锶 | 银白色,柔软 | 2.540 | 769(加压) | 1384 |
钡 | 银白色,柔软 | 3.594 | 729 | 1637 |
展开表格
ⅢB族(不含镧系和锕系)
IIIB族元素单质 | 颜色 | 密度(×10³kg/m³) | 熔点(℃) | 沸点(℃) |
钪 | 银白色 | 2.985 | 1541 | 2830 |
钇 | 灰色 | 4.4689 | 1522 | 3338 |
镧系
镧系元素单质 | 颜色 | 密度(×10³kg/m³) | 熔点(℃) | 沸点(℃) |
镧 | 银白色 | 6.7 | 920 | 3469 |
铈 | 灰色 | 6.9 | 799 | 3426 |
镨 | 银灰色 | 6.7 | 935 | 3212 |
钕 | 银灰色 | 7.0 | 1024 | 3074 |
钷 | ? | 6.5 | 1042 | 3000 |
展开表格
ⅣB族
元素单质 | 颜色 | 密度(×10³kg/m³) | 熔点(℃) | 沸点(℃) |
钛 | 银白色 | 4.5 | 1660 | 3287 |
锆 | 银白色 | 6.5 | 1852 | 4377 |
铪 | 银白色 | 13.3 | 2227 | 4602 |
ⅤB族
元素单质 | 颜色 | 密度(×10³kg/m³) | 熔点(℃) | 沸点(℃) |
钒 | 银白色 | 6.1 | 1890 | 3380 |
铌 | 银白色 | 8.6 | 2468 | 4742 |
钽 | 银白色 | 16.6 | 2996 | 5425 |
ⅥB族
元素单质 | 颜色 | 密度(×10³kg/m³) | 熔点(℃) | 沸点(℃) |
铬 | 银白色 | 7.2 | 1857 | 2642 |
钼 | 银色 | 10.2 | 2610 | 4615 |
钨 | 银色 | 19.3 | 3410 | 5555 |
ⅦB族
元素单质 | 颜色 | 密度(×10³kg/m³) | 熔点(℃) | 沸点(℃) |
锰 | 银白色 | 7.44 | 1246 | 2061 |
锝 | 银色 | 11.487 | 2200 | 4877 |
铼 | 银色 | 21.04 | 3180 | 5627 |
Ⅷ族
元素单质 | 颜色 | 密度(×10³kg/m³) | 熔点(℃) | 沸点(℃) |
铁 | 银白色 | 7.86 | 1535 | 2861 |
钴 | 银灰色 | 8.9 | 1495 | 2527 |
镍 | 银白色 | 8.9 | 1453 | 2913 |
钌 | 银白色 | 12.3 | 2250 | 4150 |
铑 | 银色 | 12.41 | 1966 | 3695 |
展开表格
ⅠB族
元素单质 | 颜色 | 密度(×10³kg/m³) | 熔点(℃) | 沸点(℃) |
铜 | 紫红色 | 8.92 | 1084.6 | 2562 |
银 | 银白色 | 10.5 | 961 | 2162 |
金 | 金黄色 | 19.3 | 1046.68 | 2856 |
ⅡB族
元素单质 | 颜色 | 密度(×10³kg/m³) | 熔点(℃) | 沸点(℃) |
锌 | 银白色 | 7.14 | 419.6 | 907 |
镉 | 银灰色 | 8.65 | 320.9 | 765 |
汞 | 银白色 | 13.59 | -38.87 | 356.6 |
ⅢA族
元素单质 | 颜色 | 密度(×10³kg/m³) | 熔点(℃) | 沸点(℃) |
硼 | 黑色 | 2.34 | 2076 | 3927 |
铝 | 银白色 | 2.7 | 660 | 2327 |
镓 | 银白色 | 5.904 | 29.76 | 2403 |
铟 | 银白色 | 7.31 | 156.2 | 2080 |
铊 | 银白色 | 11.85 | 308.5 | 1457 |
ⅣA族
ⅤA族
元素单质 | 颜色 | 密度(×10³kg/m³) | 熔点(℃) | 沸点(℃) |
氮 | 无色 | 0.0012506 | -209.86 | -195.8 |
磷 | 黄白色(白磷) | 1.828 | 44.1 | 280.5 |
2.34 | 59 | 200 | ||
砷 | 灰黑色(灰砷) | 5.73 | 817 | 614 |
锑 | 银白色 | 6.697 | 630.63 | 1587 |
展开表格
ⅥA族
元素单质 | 颜色 | 密度(×10³kg/m³) | 熔点(℃) | 沸点(℃) |
氧 | 无色 | 0.00143 | -222.65 | -182.95 |
硫 | 淡黄色 | 2.07 | 115.36 | 444.6 |
硒 | 红色(红硒) | 4.81 | 221 | 685 |
碲 | 银白色 | 8.24 | 449.65 | 988 |
钋 | 银白色 | 9.4 | 254 | 962 |
ⅦA族(卤素)
元素单质 | 颜色 | 密度(×10³kg/m³) | 熔点(℃) | 沸点(℃) |
氟 | 浅黄绿色 | 0.0017 | -219.52 | -188.12 |
氯 | 绿色 | 0.00321 | -100.84 | -34.04 |
溴 | 棕红色 | 3.119 | -7.1 | 58.8 |
碘 | 紫黑色 | 4.93 | 133.5 | 154.3 |
砹 | ? | 10 | 302 | 337 |
0族(稀有气体)
元素单质 | 颜色 | 通电后发光颜色 | 密度(×10³kg/m³) | 熔点(℃) | 沸点(℃) |
氦 | 无色 | 紫色 | 0.00013 | -272.98(加压) | -268.93 |
氖 | 无色 | 红色 | 0.0009 | -248.45 | -246.08 |
氩 | 无色 | 天蓝色 | 0.00178 | -189.19 | -185.95 |
氪 | 无色 | 淡红色 | 0.00374 | -157.22 | -153.22 |
氙 | 无色 | 白色 | 0.00589 | -111.7 | -108.12 |
展开表格
1、由于稀有气体有在通电时发出彩光的特性,所以可以将其制成霓虹灯。
2、
放射性元素
原子序数 | 元素单质 | 密度(×10³kg/m³) | 熔点(℃) | 沸点(℃) |
43 | 锝 | 11.487 | 2200 | 4877 |
61 | 钷 | 7.22 | 931 | 3000 |
84 | 钋 | 9.4 | 254 | 962 |
85 | 砹 | 10 | 302 | 337 |
86 | 氡 | 0.00973 | -71 | -61.7 |
展开表格
注:
1.放射性元素硬度多数不详。
2.锎之后的元素各项性质均不详。
3.铋放射性太弱,不归入最后一表。
元素命名

元素周期表
位置关系
原子半径

元素周期表[化学元素周期列表]
(2)同一族的元素从上到下,随电子层数增多,原子半径增大。(五、六周期间的副族除外)
元素化合价
(1)除第1周期外,同周期从左到右,第二周期元素最高正价由碱金属+1递增到氮元素+5(氟无正价,氧无最高正价),其他周期元素最高正价由碱金属+1递增到+7,非金属元素负价都由碳族-4递增到-1。
(2)同一主族的元素的最高正价、最低负价均相同。(ⅥA、ⅦA、0族除外)
单质的熔点
(2)同一族元素从上到下,元素组成的金属单质的熔点递减,非金属单质的熔点递增。(副族不规则)
元素的金属性
(1)同一周期的元素从左到右金属性递减,非金属性递增;
最高价氧化物的酸碱性
非金属气态
单质的氧化性
一般元素的金属性越强,其单质的还原性越强,其氧化物的氧离子氧化性越弱;元素的非金属性越强,其单质的氧化性越强,其单原子阴离子的还原性越弱。
元素位置推断
1、元素周期数等于核外电子层数;
2、主族元素的序数等于最外层电子数;
3、确定族数应先确定是主族还是副族,其方法是采用原子序数逐步减去各周期的元素种数,即可由最后的差数来确定。在第一至第五周期时最后的差数小于等于10时差数就是族序数,差为8、9、10时为Ⅷ族,差数大于10时,则再减去10,最后结果为族序数;在第六、七周期时差数为1:ⅠA族,差数为2:ⅡA族,差数为3~17:镧系或锕系,差数介于18和21之间:减14,差数为22~24:Ⅷ族,差数大于25:减24,为对应的主族
根据各周期所含的元素种类推断,用原子序数减去各周期所含的元素种数,当结果为“0”时,为零族;当为正数时,为周期表中从左向右数的纵行,如为“2”则为周期表中从左向右数的第二纵行,即第ⅡA族;当为负数时其主族序数为8+结果。所以应熟记各周期元素的种数,即2、8、8、18、18、32、32。如:①114号元素在周期表中的位置114-2-8-8-18-18-32-32=-4,8+(-4)=4,即为第七周期,第ⅣA族。②75号元素在周期表中的位置75-2-8-8-18-18=21,21-14=7,即为第六周期,第ⅦB族
稀有气体元素
稀有气体也称为惰性气体 它们的化学性质很稳定,不易和其他物质发生化学反应。稳定的稀有气体为:氦(He) 氖(Ne)氩(Ar)氪(Kr) 氙(Xe)氡(Rn)
牢记稀有气体元素的原子序数:2、10、18、36、54、86,通过稀有气体的位置,为某已知原子序数的元素定位。
如:要推知33号元素的位置,因它在18和36之间,所以必在第4周期,由36号往左数,应在ⅤA族。
次级周期性
第二周期的不规则性
成因是第二周期的内层电子少(只有1s),原子半径特别小,所以第二周期元素成键的方式及种类和后面几个周期差异很大。例如氮族元素(ⅤA),第3~6周期的五氯化物均已制得,但是NF却不存在,更不必说NCl等分子了。又如碳和硅的最大配位数不同,导致了二氧化碳和二氧化硅晶体结构的不同。
第四周期的不规则性
第四周期的p区元素刚刚经过d区,所以原子半径比同族的第三周期相比变化不大。因此,第四周期元素很多化合物较不稳定,如HClO和HIO很早就被制得了,但HBrO却是在1967年才制得,且氧化性为高卤酸(高氟酸除外,因热力学不稳定)中最强。
第六周期元素原子半径太大,6s电子电子云间隔很大,不易成键。除Tl(Ⅲ)较稳定以外,其余第六周期p区元素均很难显现族价。比如BiO还原性比SbO差得多,BiO氧化性比SbO强得多,而Po(Ⅵ)和At(Ⅶ)预计不会存在。
区元素
s区元素
周期表中第1列和第2列为s区元素,他们的价电子构型分别为ns和ns。其中第1列包括氢(H)和碱金属锂(Li)、钠(Na)、钾(K)、铷(Ru)、铯(Se)、钫(Fr),即第1主族(I A)。第2列包括碱土金属铍(Be)、镁(Mg)、钙(Ca)、锶(Sr)、钡(Ba)、镭(Ra),即第2主族(II A)。这两族元素位于元素周期表左侧,它们在化学反应中参与成键的只是s电子,所以化学性质比较简单,最为突出的是其氧化物和氢氧化物的碱性,因而得名。
p区元素
周期表里的第13~18列,即III A~VIA和零族,共6族、31种元素为p区元素。它们的价电子构型为nsnp。在B、Si、As、Te下划线,可将这个区域一分为二,右上方为非金属区,左下方为金属区。21种非金属元素位于右上方,其中在常温常压下,单质为气态的共10种,其名字都有“气”字头;单质为液态的只有一种,就是溴,它的名字有“氵”旁;其他10种非金属在常温常压下为固态,都是“石”为旁。左下方的金属元素都有“钅”字旁。在斜角线两侧的元素如Si、Ge、As、Sb、Te等既有金属性也有非金属性,有半金属之称,是制造半导体材料的重要元素。p区元素最重的性质是氧化还原性和酸碱性。
d区元素
d区元素是指周期表中第3~12,即III B、IV B、V B、VI B、VIII、I B和II B族的元素,共有30种金属元素,其价电子构型为(n-1)dns,因为位于典型的金属元素(s区元素)与典型的非金属元素(p区元素)之间,d区元素和f区元素又共称为过渡元素或过渡金属。d区第四周期被称为第一过渡系,第五和第六周期分别为第二过度系和第三过度系。d区元素各族元素性质的差异源于次外层d电子的不同,所以和主族元素相比,各族之间的差别较小。
第11列的IB族的铜(Cu)、银(Ag)、金(Ag)和第12列的IIB族的锌(Zn)、镉(Ge)、汞(Hg)最外层有ns价电子,容易形成+1或+2价化合物,在认识周期律的初期认为它们与元素I A族和II A族相似,所以将它们标记为I B副族和II B副族,如今可知其次外层为18电子结构,与s区次外层为8电子结构不同,故归于d区或另立ds区都可以。
f区元素
记忆技巧
化合价记忆法
①
一价氢氯钾钠银 二价氧钙钡镁锌
三铝四硅五价磷 二三铁、二四碳
一至五价都有氮 铜汞二价最常见
②
正一铜氢钾钠银 正二铜镁钙钡锌
三铝四硅四六硫 二四五氮三五磷
一五七氯二三铁 二四六七锰为正
碳有正四与正二 再把负价牢记心
负一溴碘与氟氯 负二氧硫三氮磷
③
正一氢银和钾钠 正二钙镁钡锌汞和铜
铝正三 硅正四 亚铁正二铁正三
氯在最后负一价 氧硫最后负二价
莫忘单质价为零
④
氢正一 氧负二
一价钾钠银 二价钡镁锌钙
三价铝 铁可变价
铜汞二价最常见
⑤
钾钠氢银正一 二钙钡镁锌
硫负二正四六 铁有正二三
一二铜二四碳 单质永归零
⑥
钾钠银氢正一价,氟氯溴碘负一价;
钙镁钡锌正二价,通常氧是负二价
二三铁,二四碳,三铝四硅五价磷;
一三五七正价氯,二四六硫锰四七;
铜汞二价最常见,单质化合价为零。
⑦
一价氯氢钾钠银,二价氧钙钡镁锌,三铝四硅五价磷;
二三铁,二四碳,二四六硫要记全;
铜汞二价最常见,单质为零永不变。
⑧
一价氯氢钾钠银,二价氧钙钡镁锌,
三铝四硅五氮磷,铜一二,铁二三;
盐的溶解性记忆口诀
完全溶解不困难。
溶碱钾钠钡和氨。
盐酸溶解除银盐,
硫酸难溶是钡铅。
碳酸磷酸钾钠铵,
碳酸氢盐都溶完。
②
硫酸盐中钡不溶;氯化盐中银不溶;
碳酸盐中只溶钾、钠、铵。
碱只溶钾钠钙钡铵
③
盐酸除银汞。
碳酸磷酸盐,
能溶钾钠铵。
再说硫酸盐,
不溶有钡铅。
最后说碱类,
能溶钾钠钡。
顺口溜
元素性质口诀
我是氢,我最轻,火箭靠我运卫星;
我是氦,我无赖,得失电子我最菜;
我是锂,密度低,遇水遇酸把泡起;
我是铍,耍赖皮,虽是金属难电离;
我是硼,电子穷,我和本族大不同;
我是碳,反应慢,既能成链又成环;
我是氧,不用想,离开我就憋得慌;

元素周期表[化学元素周期列表]
我是氖,也不赖,通电红光放出来;
我是钠,脾气大,遇酸遇水就火大;
我是硅,色黑灰,信息元件把我堆;
我是磷,害人精,剧毒列表有我名;
我是硫,来历久,沉淀金属最拿手;
我是氯,色黄绿,金属电子我抢去;
我是氩,活性差,霓虹紫光我来发;
我是钾,把火加,超氧化物来当家;
我是钙,身体爱,骨头牙齿我都在;
我是钪,耐温广,高温合金我来帮;
我是钒,酸碱烦,如虎添翼钢加钒;
我是铬,正六铬,酒精过来变绿色;
我是铁,多用也,不锈钢喊我叫爷;
我是钴,蓝色母,癌症要用六十钴;
我是铜,色紫红,投入硝酸气棕红;
我是锌,人必需,体内我立大功勋;
我是镓,易熔化,六十七镓是奇葩;
我是锗,可晶格,红外窗口能当壳;
我是砷,颜色深,三价元素夺你魂;
我是硒,补人体,口服液里有玄机;
我是溴,挥发臭,液态非金我来秀;
我是氪,很耐克,通电就显橘红色;
我是铷,碱金属,沾水烟花钾不如;
我是钇,难分离,我在特种合金里;
我是锆,熔点高,石头里面很多锆;
我是铌,能吸气,网络让我当NB;
我是锝,能放射,地壳里面我没得;
我是铑,光泽好,抗腐蚀性我很好;
我是镉,污染的,当年日本痛痛得;
我是铟,软如金,轻微放射宜小心;
我是锑,非Sb,虽说锑锅那是铝;
我是碲,毒性低,又是金属又非金;
我是碘,升华烟,遇到淀粉蓝点点;
我是铯,金黄色,入水爆炸容器破;
我是钡,硫酸钡,可以用来检查胃;
我们是镧系,个个都很稀;
钕能用来造磁铁;
钷有放射性;
钐!铕!钆!铽!合金很奇特;
还有镝钬铒铥镱镥;
我是铪,笑哈哈,我和锆矿是一家;
我是钨,高温度,其他金属早呜呼;
我是锇,和铱合,保持百年很耐磨;
我是铱,做钢笔,只有千万分之一;
我是铂,很贵重,含量比金还淡薄;
我是金,很稳定,扔进王水影无形;
我是汞,吸入痛,温度高低我能懂;
我是铊,能脱发,它是有毒的东西;
我是铅,能储电,子弹头里也出现;
我是砹,极少在,要找到我很难哎;
我是氡,放射中,三天我就造真空;
我是钫,人造上,廿三分钟我就亡;
我们是锕系,个个会放粒;
锕!钍!镤!航飞做热源;
铀造原子弹很牛;
镎也造炸弹;
还有锎锿镄钔锘铹;
再加上我们,我们都超重;
主族元素顺口溜
铍镁钙锶钡镭 ——媲美盖茨被雷
硼铝镓铟铊 ——碰女嫁音他
碳硅锗锡铅 ——探归者西迁
氮磷砷锑铋 ——蛋临身体闭
氧硫硒碲钋 ——养牛西蹄扑
氟氯溴碘砹——父女绣点爱
氦氖氩氪氙氡 ——害耐亚克先动
参考资料
[1]
化学元素周期表 · 化学元素周期表[引用日期2014-09-28]
[2]
门捷列夫元素周期表 · 化学元素周期表[引用日期2014-09-28]
[3]
元素周期表新添4个元素 均为人工合成 · 网易探索[引用日期2016-01-06]
[4]
全国科技名词委联合国家语言文字工作委员会召开113号、115号、117号、118号元素中文定名会 · 全国科学技术名词审定委员会[引用日期2017-02-17]
[5]
(钅+哥)的释义 · 字海网[引用日期2018-01-28]
展开