卤族元素(周期系ⅦA族元素)

VLoG
次浏览
更新时间:2023-05-23
卤族元素
周期系ⅦA族元素

基本信息
| 中文名 | 卤族元素 |
| 外文名 | Halogen |
| 含义 | 周期系ⅦA族元素,有毒非金属 |
| 别名 | 卤素 |
| 包括 | 氟、氯、溴、碘、砹、石田 |
命名
由于卤素可以和很多金属形成盐类,因此英文卤素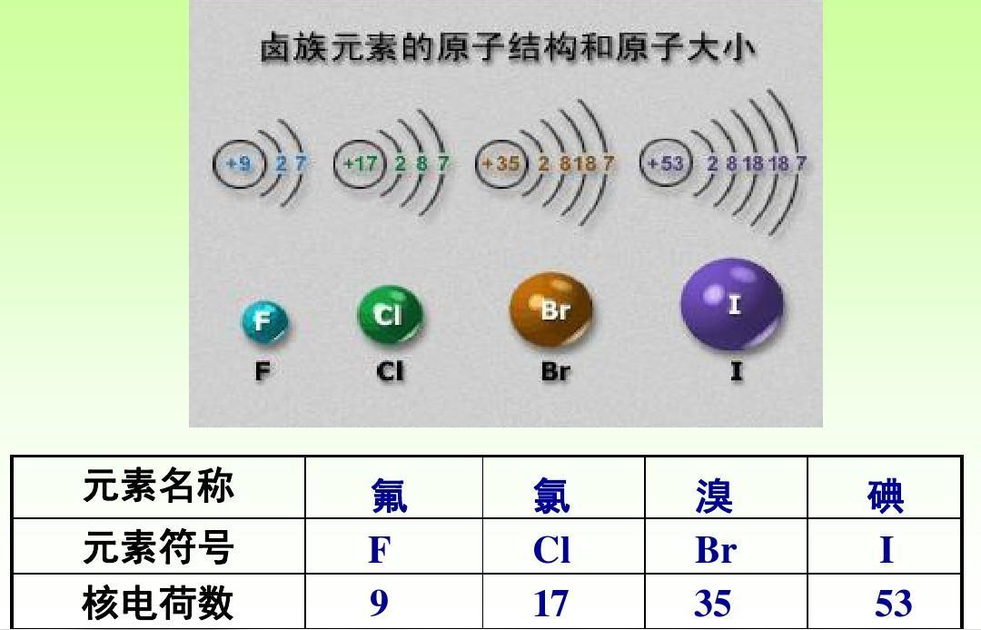 (halogen)来源于希腊语halos(盐)和gennan(形成)两个词。在中文里,卤的原意是盐碱地的意思。
(halogen)来源于希腊语halos(盐)和gennan(形成)两个词。在中文里,卤的原意是盐碱地的意思。

卤族元素
卤素元素
氟(F)
共价半径/Å:
0.72电子构型: 1s 2sp
其他:K/Na + 单一卤素的均为白色,液体透明无色
氯(Cl)

卤族元素
原子序数:17
相对原子质量:35.4527
原子半径/Å:0.97
原子体积/cm/mol: 22.7
共价半径/Å:0.99
电子构型: 1s 2sp 3sp
离子半径/Å:1.81
- CCl4溶液:黄绿色
- 苯溶液:黄绿色
- 银盐:AgCl:白色,难溶于水
溴(Br)
英文名称:Bromine
卤族元素
相对原子质量:79.904
原子半径/Å:1.12
原子体积/cm/mol: 23.5
共价半径/Å:1.14
电子构型: 1s 2sp 3spd 4sp
离子半径/Å:1.96
相关颜色:
- CCl4溶液:橙红色
- 苯溶液:橙红色
- 酒精溶液:橙红色
碘(I)
原子序数:53
相对原子质量:126.90447
原子半径/Å:1.32
原子体积/cm/mol:25.74
电子构型:1s 2sp 3spd 4spd 5sp
离子半径/Å:2.2
共价半径/Å:1.33
相关颜色:
- CCl4溶液:紫色
- 苯溶液:紫色
- 酒精溶液:褐色
碘在常温下为紫黑色固体,具有毒性,易溶于汽油、乙醇、苯等溶剂,微溶于水,加碘化物可增加碘的溶解度并加快溶解速度。100g水在常温下可溶解约0.02g碘。低毒,氧化性弱,有多种可变化合价。有升华性,加热即升华,蒸汽呈紫红色,但无空气时为深蓝色。有时需要加水封存。氢碘酸为无放射性的最强氢卤酸,也是无放射性的最强无氧酸。但腐蚀性是所有无放射氢卤酸中最弱的,因为碘原子的半径较大,电子亲和能与电负性较小,易于损失氢离子。有还原性。碘是所有卤族元素中最安全的,因为氟、氯、溴的毒性、腐蚀性均比碘强,而砹虽毒性比碘弱,但有放射性。但是,碘对人体并不安全,尤其是碘蒸气,会刺激粘膜。即使要补碘,也要用无毒的碘酸盐(如碘酸钾KIO₃)。所以所有的卤族元素对人体都不安全。
砹(At)
英文名称:Astatine

卤族元素
相对原子质量:209.9871
原子半径/Å: 0.57
原子体积/cm/mol:17.1
共价半径/Å:0.72
电子构型: 1s 2sp 3spd 4spdf 5spd 6sp
离子半径/Å:1.33
钿(Ts)
英文名:Tennessine
原子序数:117
原子质量:294
原子半径:未知
原子体积:未知
共价半径:156-157pm(推算)
电子构型:[氡]5f6d7s7p
电子排布:2/8/18/32/32/18/7(预测)
第一电离能:742.9kJ/mol(预测)
2010年,总部位于俄罗斯首都莫斯科郊外的杜布纳联合核研究所成功合成了117号新元素——在实验室人工创造的最新的超重元素。一篇描述了这个新发现论文已经被《物理评论快报》接受发表。新元素目前尚未被命名,放入元素周期表的116号元素和118号元素之间的位置,这两者都已经被发现。这种超重元素通常是具有非常强的放射性,并且几乎立即会发生衰变。但是,许多研究人员认为甚至更重的元素也可能占据一个可以让超重原子坚持了一段时间“稳定岛”。新的工作进一步支撑了一观点。对新元素的进行放射性衰变分析后,尤里的研究小组在新的论文中写道:“为预测超重元素‘稳定岛’的存在提供了试验验证”。由俄罗斯杜布纳的联合核研究所的尤里领导的研究小组报告称用含有97个质子和152个中子的锫-249轰击钙Ca-48——一种有20个质子和28个中子组成的Ca-40的同位素。撞击会生成两种拥有117个质子的同位素,其中一种核素有176个中子,而另一种核素有177个中子。
2012年,俄罗斯科研小组再次成功合成117号元素,从而为117号元素正式加入元素周期表扫清了障碍。虽然2010年就首次成功合成了117号元素,然而国际理论与应用化学联合会(IUPAC)要求杜布纳联合核研究所再次合成该元素,之后他们才能正式批准将它加入元素周期表。杜布纳联合核研究所的一名高级负责人说,研究小组已经成功完成了验证工作,并向IUPAC正式提交117号元素的登记申请;如果顺利,117号元素将会在一年内被命名,并归入元素周期表。据悉,杜布纳联合核研究所使用粒子回旋加速器,用由20个质子和28个中子组成的钙48原子,轰击含有97个质子和152个中子的锫249原子,生成了6个拥有117个质子的新原子,其中的5个原子有176个中子,另一个原子有177个中子。
国际化学协会(IUPAC) 最终确定117号元素由美国劳伦斯利弗莫尔国家实验室、橡树岭国家实验室和俄罗斯布纳(Dubha)联合核研究所的科学家共同合成。117号元素命名为以“田纳西州”英文地名拼写为开头tennessine的(缩写Ts),而中文汉字为新造元素字(石田)。
元素性质
原子结构特征
相似性
卤素的化学性质都很相似,它们的最外电子层上都有7个电子,有取得一个电子形成稳定的八隅体结构的卤离子的倾向,因此卤素都有氧化性,原子半径越小,氧化性越强,因此氟是单质中氧化性最强者。除F外,卤素的氧化态为+1、+3、+5、+7,与典型的金属形成离子化合物,其他卤化物则为共价化合物。卤素与氢结合成卤化氢,溶于水生成氢卤酸。
2F2(g)+2H2O(l)=4HF(aq)+O2(g)
卤素之间形成的化合物称为互卤化物,如ClF₃(三氟化氯)、ICl(氯碘化合物)。卤素还能形成多种价态的含氧酸,如HClO、HClO₂、HClO₃、HClO₄。卤素单质都很稳定,除了I₂以外,卤素分子在高温时都很难分解。卤素及其化合物的用途非常广泛。例如,我们每天都要食用的食盐,主要就是由氯元素与钠元素组成的氯化物,并且还含有有少量的MgCl₂。
递变性
单质氧化性:F2>Cl2>Br2>I2
阴离子还原性:F
卤素单质的毒性,从F开始依次降低。
另外,卤素的化学性质都较活泼,因此卤素只以化合态存在于自然界中。
条件 | 特殊现象 | 产物稳定性 | ||
F2 | 暗处 | 剧烈化合并发生爆炸 | 很稳定 | H2(g)+F2(g)= 2HF(g) |
Cl2 | 光照或点燃 | ——————— | 较稳定 | H2(g)+Cl2(g)=2HCl(g)(点燃或光照) |
Br2 | 加热 | ——————— | 稳定性差 | H2(g)+Br2(g)= 2HBr(g)(加热) |
I2 | 不断加热 | 缓慢反应 | 不稳定 | H2(g)+I2(g)=2HI(g)(不断加热) |
①剧烈程度:逐渐减弱 ②生成HX的稳定性:与氢反应的条件不同,生成的气体氢化物的稳定性不同, HF>HCl>HBr>HI。
无氧酸的酸性不同:HI>HBr>HCl>HF。
氯气难溶于饱和氯化钠溶液,而碘易溶于碘化钾溶液(生成I3)
注意:萃取和分液的概念
·在溴水中加入四氯化碳振荡静置有何现象?(分层,下层橙红色上层无色)
卤离子的鉴别
氯离子:得白色沉淀 Ag(aq)+ Cl(aq)——→AgCl(s)
溴离子:得淡黄色沉淀 Ag(aq)+ Br(aq)——→AgBr(s)
碘离子:得黄色沉淀 Ag(aq)+ I(aq)——→AgI(s)
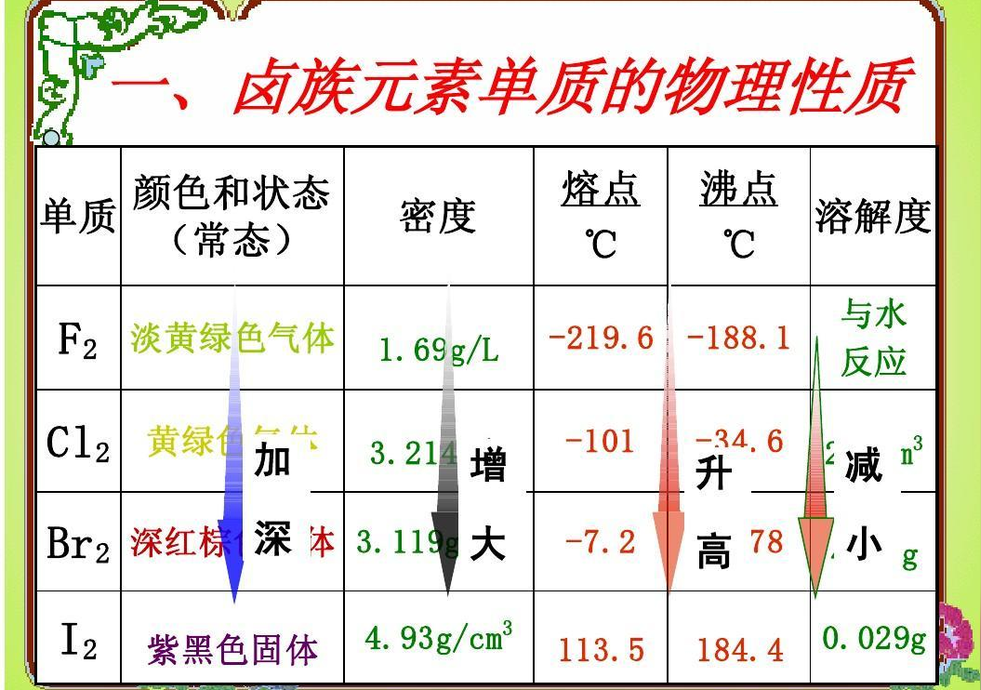
卤素的物理、化学特性
通常来说,液体卤素分子的沸点均要高于它们所对应的烃链(alcane)。这主要是由于卤素分子比烃链更易电极化,而分子的电极化增加了分子之间的连接力(正电极与负电极的相互吸引),这使我们需要对液体提供更多的能量才能使其蒸发。
* 由于卤素原子相较于碳原子,通常体积和质量较大,所以C-X连接的偶极子矩(Dipole Moment)和键能(Bonding Energy)远大于C-H,这些导致了C-X的连接力(Bonding strength)远小于C-H连接。
* 卤素原子脆弱的p轨道(Orbital)与碳原子稳定的sp轨道相连接,这也大大降低了C-X连接的稳定性。
位于元素周期表右方的卤族元素是典型的非金属。卤素的电子构型均为nsnp,它们获取一个电子以达到稳定结构的趋势极强烈。所以化学性质很活泼,自然状态下不能以单质存在,一般化合价为-1价,即卤离子(X-)的形式。
卤素单质都有氧化性,氧化性从氟到碘依次降低。碘单质氧化性比较弱,三价铁离子可以把碘离子氧化为碘。
卤素单质在碱中容易歧化,方程式为:
3X(g)+6OH(aq)——→5X(aq)+ XO3(aq)+3H2O(l)
但在酸性条件下,其逆反应(归中)很容易进行:
5X(aq)+XO3(aq)+6H(aq)——→3X2(g)+3H2O(l)
这一反应是制取溴和碘单质流程中的最后一步。
卤素的氢化物叫卤化氢,为共价化合物;而其溶液叫氢卤酸,因为它们在水中都以离子形式存在,且都是酸。氢氟酸一般看成是弱酸,pKa=3.20。氢氯酸(即盐酸)、氢溴酸、氢碘酸都是化学中典型的强酸,它们的pKa均为负数,酸性从HCl到HI依次增强。
卤素可以显示多种价态,正价态一般都体现在它们的含氧酸根中:
卤素的含氧酸均有氧化性,同一种元素中,次卤酸的氧化性最强。
卤素的含氧酸多数只存在于溶液中,而少数盐是以固态存在的,如碘酸盐和高碘酸盐。HXO(X=F、Cl、Br)、HIO3和HXO4(X=Cl、Br、I)分子在气相中十分稳定,可用质谱和其他方法研究。卤素存在的含氧酸见下表。
展开表格
卤素的有机化学反应
在有机化学中,卤族元素经常作为决定有机化合物化学性质的官能团存在。
氯的存在范围最广,按照氟、溴、碘的顺序减少,砹是人工合成的元素。卤素单质都是双原子分子,都有很强的挥发性,熔点和沸点随原子序数的增大而增加。常温下,氟、氯是气体、溴是液体,碘是固体。
通常的化学式如:
Nu + R-X =R-Nu + X
"Nu-"在这里代表亲核负离子,离子的亲核性越强,则产率和化学反应的速度越可观。
"X"在这里代表卤素原子,如F、Cl、Br、I,若X所对应的酸(即HX)为强酸,那么产率和反应的速度将非常可观,如果若X-所对应的酸为弱酸,则产率和反应的速度均会下降。
卤素的制成:
不需要催化剂的情况下,产率90%以上。
* 如果希望将Br加在烃链第一个碳原子上,可以使用Karasch的方式:
CH3-CH2-CH=CH?+ HBr ——→ CH3-CH2-CH2-CH2-Br + H2O
催化剂:H2O?
产率90%以上。
* 从苯制作卤素则必须要通过催化剂,如:
C6H6+ Br2——→C6H5-Br
催化剂:FeBr3或者AlCl3
产率相当可观。
注意此反应为平衡反应,故产率和速度有限。
ⅦA 族元素包括氟( F )、氯 (Cl) 、溴( Br )、碘( I )、砹( At ),合称卤素。其中砹( At )为放射性元素,在产品中几乎不存在,前四种元素在产品中特别是在聚合物材料中以有机化合物形式存在。应用于产品中的卤素化合物主要为阻燃剂: PBB , PBDE , TBBP-A , PCB ,六溴十二烷,三溴苯酚,短链氯化石蜡;用于做冷冻剂、隔热材料的臭氧破坏物质: CFCs 、 HCFCs 、 HFCs 等。
危害:在塑料等聚合物产品中添加卤素(氟,氯,溴,碘)用以提高燃点,其优点是:燃点比普通聚合物材料高,燃点大约在 300℃ 。燃烧时,会散发出卤化气体(氟,氯,溴,碘),迅速吸收氧气,从而使火熄灭。但其缺点是释放出的氯气浓度高时,引起的能见度下降会导致无法识别逃生路径,同时氯气具有很强的毒性,影响人的呼吸系统,此外,含卤聚合物燃烧释放出的卤素气在与水蒸汽结合时,会生成腐蚀性有害气体(卤化氢),对一些设备及建筑物造成腐蚀。
因此,不少国际大公司在积极推动完全废止含卤素材料,如禁止在产品中使用卤素阻燃剂等。
然而对于无卤化的要求,不同的产品有不同的限量标准:
如无卤化电线电缆其中卤素指标为:所有卤素的值 ≦50PPM
(根据法规 PREN 14582) :燃烧后产生卤化氢气体的含量<100PPM
(根据法规 EN 5067-2-1) :燃烧后产生的卤化氢气体溶于水后的 PH 值大于等于4.3( 弱酸性 )
(根据法规 EN-5 0267-2-2):产品在密闭容器中燃烧后透过一束光线其透光率 ≧60%
(根据法规 EN-50268-2) 。
元素名称 | 氟 | 氯 | 溴 | 碘 |
状态 | 气体 | 气体 | 液体 | 固体 |
颜色 | 淡黄色 | 黄绿色 | 棕红色 | 紫黑色 |
单质还原性 | 逐渐减小 | |||
氢化物的酸性 | 逐渐增强 | |||
活性 | 逐渐减弱 | |||
国际法规
IEC 61249-2-21
·氯限值≤900ppm
·溴限值≤900ppm
·溴+氯含量≤1500ppm
国际印刷电路协会标准 IPC4101B
·氯限值≤900ppm
·溴限值≤900ppm
·溴+氯含量≤1500ppm
日本印刷电路板协会(JPCA-ES-01-1999)
·氯限值≤900ppm
·溴限值≤900pp
卤素单质在不同溶剂中的颜色
氯 | 溴 | 碘 | |
水 | 黄绿色 | 黄色至橙色 | 深黄色至褐色 |
苯 | 橙色至橙红 | 浅紫色至紫色 | |
四氯化碳 | 紫色至深紫色 | ||
汽油 | 浅紫红色至紫红 | ||
酒精 | 棕色至深棕色 |
·



