烷烃(开链的饱和链烃)

VLoG
次浏览
更新时间:2023-05-19
烷烃
开链的饱和链烃
有机化合物
烷烃(wán tīng),是开链的饱和链烃(saturated group),分子中的碳原子都以单键相连,其余的价键都与氢结合而成的化合物。通式为CnH2n+2,是最简单的一种有机化合物。烷烃的主要来源是石油和天然气,是重要的化工原料和能源物资。
基本信息
| 中文名 | 烷烃 |
| 闪点 | 60 |
| 别名 | 饱和烃 |
| 密度 | 小于水,即<1kg/m^3 |
| 外观 | 无色透明 |
展开
定义
物质结构
化学式
从甲烷开始,每增加一个碳原子就相应地增加两个氢原子,因此烷烃的通式为CH,n表示碳原子的数目(n=1,2,3,···),理论上n可以很大,但已知的烷烃n大约在100以内。拥有相同分子通式和结构特征的一系列化合物称为同系列,烷烃同系差为CH,C原子个数不同的烷烃互为同系物。同系列中的同系物的结构相似,化学性质相近,物理性质随着碳原子的增加而呈现规律性变化。
物理性质
气味
低沸点(boiling point)的烷烃为无色液体,有特殊气味;高沸点烷烃为黏稠油状液体,无味。
物态
烷烃的物理性质随分子中碳原子数的增加,呈现规律性的变化。
在室温25°下,含有1~4个碳原子的烷烃为气体。
含有5~17个碳原子的烷烃为液体。但实际上含有10~19个碳原子的烷烃正常温度下可以为固体。
熔点
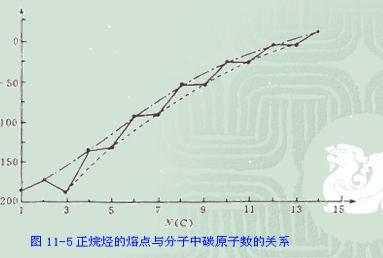
烷烃
通过X射线衍射方法分析,固体正烷烃晶体为锯齿形,在奇数碳原子齿状链中两端甲基同处在一边,如正戊烷。偶数碳链中两端甲基不在同一边,如正己烷,偶数碳链彼此更为靠近,相互作用力大,故熔点升高值较单数碳链升髙值较大一些。
密度
烷烃的密度(density)随相对分子质量增大而增大,这也是分子间相互作用力的结果,分子间引力增大,分子间的距离相应减小,相对密度则增大,密度增加到一定数值后,相对分子质量增加而密度变化很小。最大接近于0.8 g·cm 左右,所以所有的烷烃都比水轻。
溶解度
与碳原子数相等的链烷烃相比,环烷烃的沸点、熔点和密度均要髙一些。这是因为链形化合物可以比较自由地摇动,分子间“拉”得不紧,容易挥发,所以沸点低一些。由于这种摇动,比较难以在晶格内做有次序的排列,所以熔点也低一些。由于没有环的牵制,链形化合物的排列也较环形化合物松散些,所以密度也低一些。同分异构体和顺反异构体也具有不同的物理性质。下表是若干烷烃和环烷烃的物理常数。
展开表格
化学性质
卤化反应
烷烃中的氢原子被卤原子取代的反应称为卤化反应(halogenation)。卤化反应包括氟化(fluorinate),氯化(chlorizate),溴化(brominate)和碘化(iodizate)。但有实用意义的卤化反应是氯化和溴化。
1.氯化
例如甲烷与氯发生氯代反应生成四种氯代产物的混合物。其中hv表示光照
如果控制氯的用量,用大量甲烷,主要得到氯甲烷;如用大量氯气,主要得到四氯化碳。工业上通过精馏,使混合物一一分开。以上几个氯化产物,均是重要的溶剂与试剂。
甲烷氯化反应的事实是:
①在室温暗处不发生反应;
②髙于250℃发生反应;
③在室温有光作用下能发生反应;
2.甲烷的卤化
在同类型反应中,可以通过比较决定反应速率一步的活化能大小,了解反应进行的难易。
氟与甲烷反应是大量放热的,但仍需+4.2 KJ/mol活化能,一旦发生反应,大量的热难以移走,破坏生成的氟甲烷,而得到碳与氟化氢,因此直接氟化的反应难以实现。碘与甲烷反应,需要大于141 KJ/mol的活化能,反应难以进行。氯化只需活化能+16.7 KJ/mol,溴化只需活化能+75.3 KJ/mol,故卤化反应主要是氯化、溴化。氯化反应比溴化易于进行。
由基链反应中加入碘,它可以使反应中止。
3.高级烷烃的卤化
在紫外光或热(250~400℃)作用下,氯、溴能与烷烃发生反应,氟可在惰性气体稀释下进行烷烃的氟化,而碘不能。
1.碳自由基的定义和结构
某一键均裂时会产生带有孤电子的原子或基团,称之为自由基。孤电子在氢原子上的自由基称为氢自由基。孤电子在碳原子上的自由基称为碳自由基。烷烃中的碳氢键均裂时会产生一个氢自由基和一个烷基自由基即碳自由基。自由基碳sp 杂化,三个sp 杂化轨道具有平面 三角形的结构,每个sp 杂化轨道与其它原子的轨道通过轴向重叠形成σ键,成键轨道上有一对自旋相反的电子。一个p轨道垂直于此平面,p轨道被一个孤电子占据。
(1)键解离能
分子中的原子总是围绕着它们的平衡位置做微小的振动,分子振动类似于弹簧连接的小球的运动,室温时,分子处于基态,这时振幅很小,分子吸收能量,振幅增大。如果吸收了足够的能量,振幅增大到一定程度,键就断了,这时吸收的热量,是键解离反应的焓(ΔH),是这个键的键 能,或称键解离能(bond-dissociation energy),用Ed表示。
(2)碳自由基的稳定性
自由基的稳定性,是指与它的母体化合物的稳定性相比较,比母体化合物能量高得多的较不稳定,高得少的较稳定。从上面C一H键的解离能数据可以看出:CH中C—H键解离,其解离能最大,在同列系中第一个化合物往往是比较特殊的;CHCH与CHCHCH中断裂一级碳上的氢,解离能较CH稍低,形成的均为一级自由基;CHCHCH中断裂二级碳原子上的氢,其解离能又低一些,形成二级自由基;(CH)CH中三级碳原子上的氢断裂,其解离能最低,形成三级自由基。这些键解离反应中,产物之一是,均是相同的,因此键解离能的不同,是反映了碳自由基的稳定性不同。解离能越低的碳自由基越稳定。因此碳自由基的稳定性顺序为
3°C·>2°C·>1°C·>H3C·
在烷烃分子中,C—C键也可解离。
3.自由基反应的共性
化学键均裂产生自由基。由自由基引发的反应称为自由基反应,或称自由基型的链反应(chain reaction)。自由基反应一般都经过链引发(initiation )、链转移(propagation,或称链生成)、链终止(termirrntimi)三个阶段。链引发阶段是产生自由基的阶段。由于键的均裂需要能量,所以链引发阶段需要加热或光照。
热裂反应
无氧存在时,烷烃在髙温(800℃左右)发生碳碳键断裂,大分子化合物变为小分子化合物,这 个反应称为热裂(pyrolysis)。石油加工后除得汽油外,还有煤油、柴油等相对分子质量较大的烷烃;通过热裂反应,可以变成汽油、甲烷、乙烷、乙烯及丙烯等小分子的化合物,其过程很复杂,产 物也复杂;碳碳键、碳氢键均可断裂,断裂可以在分子中间,也可以在分子一侧发生;分子愈大,愈易断裂,热裂后的分子还可以再进行热裂。热裂反应的反应机制是热作用下的自由基反应,所用的原料是混合物。
总的结果是大分子烷烃热裂成分子更小的烷烃、烯烃。这个反应在实验室内较难进行,在工业上 却非常重要。工业上热裂时用烷烃混以水蒸气在管中通过800℃左右的加热装置,然后冷却到 300~400°C,这些都是在不到一秒钟时间内完成的,然后将热裂产物用冷冻法加以一一分离。塑料、橡胶、纤维等的原料均可通过此反应得到。
乙烯的世界规模年产数千万吨,而且还在不断增长。各国所用烷烃原料 不同,产物也有差别,如用石脑油为原料热裂后可得甲烷15%、乙烯31.3%、乙烷3.4%、丙烯13.1 %、丁二烯4.2%、丁烯和丁烷2.8%、汽油22%、燃料油6%,尚有一些少量其它产品。
一般在碳链中间较易断裂,然后再产生一系列的β-断裂。
芳香烃仅在侧链上发生反应,因芳环稳定,保持不变。因此,如生产乙烯最好是含直链烷烃最多的石油馏分。
氧化反应和燃烧
在生活中经常碰到这样的现象,人老了皮肤有皱纹,橡胶制品用久了变硬变黏,塑料制品用 久了变硬易裂,食用油放久了变质,这些现象称为老化。老化过程很慢,老化的原因首先是空气 中的氧进入具有活泼氢的各种分子而发生自动氧化反应(autoxidaticm),继而再发生其它反应。
所有的烷烃都能燃烧,完全燃烧时,反应物全被破坏,生成二氧化碳和水,同时放出大量热。
燃烧时火焰为淡蓝色,不明亮。
制备
碳氢化合物的主要来源是天然气(natural gas)和石油(petroleum)。尽管各地的天然气组分不同,但几乎都含有75%的甲烷、15%的乙烷及5%的丙烷,其余的为较高级的烷烃。而含烷烃种类最多的是石油,石油中含有1至50个碳原子的链形烷烃及一些环状烷烃,而以环戊烷、环己烷及其衍生物为主,个别产地的石油中还含有芳香烃。我国各地产 的石油,成分也不相同,但可根据需要,把它们分馏成不同的馏分加以应用。烷烃不仅是燃料 的重要来源,而且也是现代化学工业的原料。另外,烷烃还可以作为某些细菌的食物,细菌食用烷烃后,分泌出许多很有用的化合物,也就是说烷烃经过细菌的“加工”后,可成为更有用的化合物。
上述情况表明,石油工业的发展对于国民经济以及有机化学的发展都非常重要。
石油虽含有丰富的各种烷烃,但这是个复杂混合物,除了 C1~C6烷烃外,由于其中各组分的相对分子质量差别小,沸点相近,要完全分离成极纯的烷烃,较为困难。采用气相色谱法,虽可有效地予以分离,但这只适用于研究,而不能用于大量生产。因此在使用上,只把石油分离成几种馏分来应用,石油分析中有时需要纯的烷烃作基准物,可以通过合成的方法制备。
展开表格
汽油(petrol)在内燃机中燃烧而发生爆燃或爆震,这会降低发动机的功率并会损伤发动机。燃料引起爆震的倾向,用辛烷值(octane value)表示,在汽油燃烧范围内,将2,2,4-三甲基戊烷的辛烷值定为100。辛烷值越高,防止发生爆震的能力越强。六个碳以上的直链烷烃辛烷值很低,带支链的、不饱和的脂环、特别是芳环最为理想,有的超过100。大部分现代化的设备要求辛烷值在90~100之间。可将石脑油、常压渣油,有时也用瓦斯油经过加工,将辛烷值提髙到95左右,再掺入汽油中使用。加工方法之一是催化重整(catalytic reforming),主要将石脑油中C6以上成分芳构化(aromatization),即成芳香烃。此法除使石脑油提高辛烷值外,在化工中主要用来生产芳香烃加工方法之二为催化裂化,此法除能提高辛烷值外,在化工中主要用于生产丙烯、丁烯。
命名规则
烷烃的命名法常用的有3种,现分述如下(仅限于我国):
普通命名法
普通命名法亦称习惯命名法,适用于比较简单的烷烃。碳原子数在10以下的烷烃,分别用甲、乙、丙、丁、戊、己、庚、辛、壬、癸等天干名称表示碳原子数目,例如:CH称为甲烷,CH称为乙烷,CH称为丙烷,余此类推;碳原子数在10以上时用汉文数字表示,例如CH称为十一烷,CH称为十八烷。
为了区别异构体,可用“正”、“异”、“新”等作前缀来表示。“正”表示直链烷烃;“异”表示碳链一端具有(CH)CH—结构,此外再无其他侧链者;“新”表示碳链一端有(CH)C—结构此外再无其他侧链的含5、6个碳原子的烷烃,例如:
CH—CH—CH—CH—CH—CH正己烷
CH—CH—CH—CH—CH异己烷
∣
CH
CH
|
CH—C—CH—CH新己烷
|
CH
CH
∣
CH—CH—CH—CH2,2-二甲基丁烷
∣
CH
衍生物命名法
衍生物命名法是以甲烷为母体,把其他烷烃看作是甲烷的烷基衍生物来命名。在命名时选择连有烷基最多的碳原子,烷基按大小顺序排列,较小的排在前面。例如:
CH—CH—CH—CH
∣
CH
这种命名法虽然能反映出烷烃的分子构造,但仍不适用于构造更为复杂的烷烃。
系统命名法
这是采用国际上通用的IUPAC命名原则,并结合我国的文字特点而制定的系统命名法。直链烷烃的命名与普通命名法基本一致,只是把“正”字省略;而把带有支链的烷烃看作是直链烷烃的烷基衍生物,并按下列规定命名:
(1)选择分子中最长的碳链为主链,把支链烷基看做主链上的取代基,根据主链所含的碳原子数称为某烷。
(2)由距离支链最近的一端开始,将主链的碳原子用阿拉伯数字编号,支链所在的位置以它所连接的碳原子的号数表示。
(3)把取代基的名称写在烷烃名称的前面,如果主链上含有几个不同的取代基时,按照由小到大的顺序排列;如果含有几个相同的取代基,可以在取代基名称前面用二、三、四……来表示。
如果从碳链的任一端开始,第一个取代基的位置都相同时,则要求表示所有取代基位置的数字之和是最小的数。




