汞(毒性过渡金属元素)

VLoG
次浏览
更新时间:2023-05-17
汞
毒性过渡金属元素
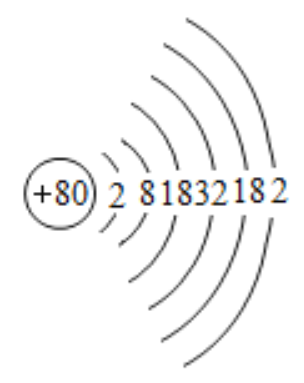
汞(Mercury,Hydrargyrum)是一种过渡金属元素,别名水银,位于元素周期表的第6周期、第IIB族,属于ds区元素,化学符号为Hg,原子量为200.59,原子序数为80,是一种无明显气味的银白色的液体,也是常温常压下唯一以液态存在的金属。汞可溶于氧化性酸,比如硝酸和热的浓硫酸,但与稀硫酸、盐酸、碱等都不反应。汞的密度较大,蒸气压也较低,因此可用于制作气压计。
基本信息
中文名
汞
英文名
Hydrargyrum, Mercury
别名
水银
原子序数
80
原子质量
200.59
族
第IIB族
周期
第6周期
CAS编号
7439-97-6
化学式
Hg
物理性质
外观
常温常压下汞为银白色液体
气味
无明显气味
密度
13579.04 kg/m³
熔点
-38.9℃(101325 pa)
沸点
357℃(101325 pa)
水溶性
可溶于硝酸和热的浓硫酸,但与稀硫酸、盐酸、碱等都不反应
原子性质
原子半径
149 pm
发现历史
人类在古代就发现了汞,公元前1-4世纪,欧洲的书中就记载了用辰砂(HgS)制作汞的方法。汞元素符号Hg则来自于拉丁语“hydrargyrum”,它由“hydra”水和“argyrum”银组成,意为“像水那样的银”。汞的英文名为Mercury,是根据罗马神话中的神“Mercurius”这个单词而来的。人们在公元前1500年的埃及墓中发现了水银的存在。在前500年左右,汞被用来和其他金属一起生产汞齐。古希腊人将它用在墨水中,古罗马人将它加入化妆品。炼金术士认为世界上所有的物质都是由水银组成的,假如他们能将汞固体化,汞就会变化为金。
中国发现并运用汞的历史也很久远。《史记》中有记载:“巴寡妇清,其先得丹穴,而擅其利数世。“丹穴”即汞矿,可以知道战国时期已经存在了采汞的矿业。又有记载秦始皇陵墓中有大量水银。根据大量出土文物的检测表明,春秋末期战国初期已有用汞齐鎏金的技术。等到明朝宋应星在撰写《天工开物》时,对冶炼汞的方法等有大量的记载,并且配有附图。清朝康熙年间田雯所撰写的《黔书》中记载了贵州提炼水银的方法:“灶有大小,锅也是这样的。大的可以容砂二十升,将其分为十层,其中的八层中,将陈汞灰布在稃粃布上面。处理的时候用勺子,中间凹陷四周凸起。盖上锅,加热,揉盐泥,涂在它周围的缝隙中。就这样进行锻造。总共一昼夜后制成汞;滴滴悬珠,十分灿烂明耀,都保留在釜的内部。”这种提炼汞的方法多地都有采用。
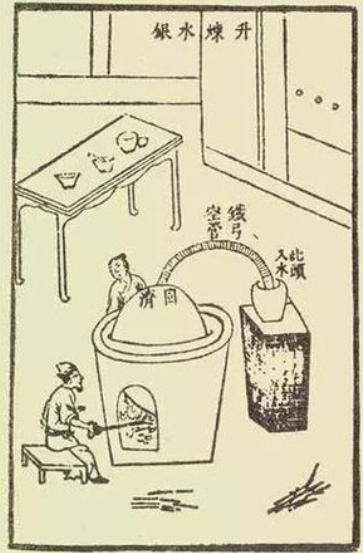
天工开物中附图,将导管在天锅上方引出,将水银蒸气导入旁边的容器中,冷却凝结成水银
分布情况
汞的分布
汞在自然界中分布广泛,但含量极少,在地壳中的含量为8.3x10⁻⁶%,在自然界表现为自然元素或汞的离子化合物两种形式,主要以化合物辰砂(HgS)的形式存在,少部分以游离态的形式存在,具有强烈的亲硫性和亲铜性。
已发现的汞矿物或含汞矿物有二十多种,其中汞的硫化物占到了绝大部分,其次是少量的自然汞、硒化物、碲化物、硫盐、卤化物及氧化物等。常见的矿物有自然汞、辰砂、黑辰砂、甘汞、绿汞、橙红石等。其中,作为工业矿物原料,其有开采价值的主要是辰砂、黑辰砂。在冶炼含汞矿物时,辰砂富矿石可以直接投入炉冶炼,但其他大多数的汞矿床含汞量较低,开采得到的矿石需要采用选矿方法,将所得矿石富集成精矿才能进行冶炼。
迁移与转化
汞在常温下即可蒸发。全球大气中的汞可能来自人类活动或自然过程,气态汞进入大气后会通过大气的传播而遍布全球。根据报道,人为汞排放量占空气中气态汞总量的33%-40%,其中两个最大的排放源为燃煤发电厂和氯碱厂,但是随着近年来氯碱工业的生产工艺改造,氯碱厂的排放量已经大大减少。采矿业也是大气中气态汞的主要来源之一,采矿过程中大约有1/4开采总量的汞会以气态汞的形式进入大气循环。自然界气态汞释放量中>50%来源于海洋中汞的蒸发,另外还包括火山活动、森林大火或生物循环等。
汞元素有强烈的神经毒性,但不同状态的汞有着巨大的毒性差异,各种价态的汞在人体内的积累是产生毒害作用的主要途径,而不同种类的汞化物的生物积累能力有显著差异。
甲基汞可以被硅藻或其他浮游生物吸收入体内并可以有效地参与生物组织的生长,因此很容易通过食物链进行积累和传播。这些不同汞化合物的吸收和应用机制,使甲基汞成为最容易生物积累的品种。通过食物链的传播和积累,甲基汞占生物体内总汞含量从食物链底端的浮游植物体内的15%,浮游动物体内的30%,上升到食物链顶端鱼类体内的95%。同时,人类摄入汞的主要来源是食用被汞污染的鱼类,这使得控制水中的甲基汞浓度变得尤为重要。
汞在自然界中形态转化的主要路径分为化学反应途径和生物反应途径。汞的化学转化路径包括通过光催化反应、化学氧化还原反应在不同价态、不同化合态汞之间进行转换。生物反应途径中需要生物体内催化酶的参与和调节。以微生物为媒介进行的汞形态转化过程中,任何可能影响到微生物生长速度、菌群数量和种类分布的因素都将对甲基化反应的可能性和进程产生影响。具体的可能转化路径概括如下:
转化过程 | 途径 | 原理 |
Hg(II) | 生物 | 甲基维生素B12以SRB为主体通过乙酰基-CoA路径的转甲基反应: |
化学 | 腐殖酸、富里酸的甲基化反应:羧酸和甲基锡、砷、铅化合物的甲基化 | |
CH3Hg(I) 去甲基化反应 | 生物 | mer-基因组催化的还原去甲基化反应生成CH₄ and Hgº;未知机理的氧化去甲基化反应生成CO₂和Hg²⁺ |
化学 | 200~400 nm 光辐射催化光解作用 | |
Hg(II) | 生物 | 汞还原菌作用;藻类通过未明确反应机理在生长过程中还原反应 |
化学 | 光化学还原:无光条件黑暗中通过有机和无机的自由基还原反应 | |
Hg(0) 氧化反应 | 生物 | 通过微生物,植物或动物体内的氢过氧化酶催化氧化 |
化学 | 光催化氧化反应:不同氧化剂和自由基氧化反应;盐碱条件下和氧气发生反应 |
汞形态转化路径总结表
理化性质
物理性质
汞是唯一一种在常温(25 ℃)常压下以液态形式存在的金属,熔点为-38.83℃,沸点为356.73℃,密度为13579.04 kg/m³,有着良好的导电性。汞在常温下会挥发出汞蒸气,有剧毒。天然的汞是由其七种同位素组成的混合物。
汞齐具有剧毒,但相比于汞单质,汞齐中所含有的稳定的金属键使得汞无法挥发成为汞蒸气。比如当前广泛采用的银汞齐补牙材料,已被证明虽然在使用过程中会缓慢释放汞蒸气,但表现并无明显毒性。受观测的儿童汞齐充填者的尿汞水平较对照高,但是仍在正常范围之内。
液态
汞在常温下表现为液态,其原因大致如下。汞的6s轨道很稳定,激发能远远超过同族元素镉和锌的相应激发能。按照一般周期规律,能量间隔应随主量子数的增加而减小,因此,从镉到汞能量间隔的增加显得尤其突兀,这里可以再次看到正是相对论收缩效应致使全满的6s²壳层安然稳定,于是汞的6s²6p能量间隔骤增。只要得不到所需的激发能,具有惰性6s²壳层的汞原子之间就无法形成强键。基态汞仅靠范德华力相互维系,所以金属汞在常温下呈液态。
化学性质
3Hg+8HNO₃→3Hg(NO₃)₂+2NO+4H₂O
Hg+2H₂SO₄→HgSO₄+SO₂+2H₂O
当汞过量时会生成亚汞盐。
Hg+Hg(NO₃)₂→Hg₂(NO₃)₂
汞可以和氧气在加热的条件下发生反应,生成氧化汞。
2Hg+O₂→2HgO(加热)
汞与硫在常温下即可发生反应,该反应常被用来处理洒落的汞。
Hg+S→HgS(研磨)
汞还可以与其他强氧化剂发生反应,比如Cl₂。
Hg+Cl₂→HgCl₂(加热)
同位素
汞有七种稳定同位素:汞196、汞198、汞199、汞200、汞201、汞202、汞204。天然汞为这七种同位素的混合物。
同位素测定时使用标样-样品交叉测定法(Standard-Sample Braketing,SSB)进行质量分馏校正,主要原理如下:通过测量2次已知标准,中间夹一次待测样品。假定已知标准和待测样品的仪器质量分馏一样,用已知标准(NIST SRM3133)来进行仪器的样品质量分馏校正。为保证同位素测试的准确度和精度,地质样品汞同位素通常还会使用UM-Aladén作为第二标准,穿插于样品中进行同样的同位素测试。MC-ICP-MS分析汞同位素的精度可达±0.1‰(2σ)。
生产方法
汞的制备主要分为火法和湿法,其中以火法为主,湿法为次。
火法
HgS(s)+O₂(g)→Hg(g)+SO₂(g)(650-750℃)
4HgS(s)+4CaO(s)→4Hg(g)+3CaS(s)+CaSO₄(s)(加热)
湿法
HgS(s)+Na₂S(aq)→Na₂HgS₂(aq)(加热)
应用领域
汞作为一种重要的金属元素,在工业、医药等方面有着广泛的应用。
冶金
冶金中采用混汞法提取金。另外,冶金中也常采用汞齐法提取金、银等金属。混汞法提取金的过程主要是把汞齐置于烧煤炉子的铸铁管状蒸馏器中进行蒸馏,连接水冷冷凝器使得蒸出的汞得到收集,同时,海绵状的黄金则会附着于蒸馏圆管的内壁。汞齐法的主要流程是,将水与汞混合,开动电碾,粉碎矿石的同时使得金与汞生成汞齐。随后,细小的金粒、化合态金等则会流入沉降池。一段时间后提取出汞齐,经处理可以得到极高纯度的黄金。而汞则可以重复利用,重复提取剩余矿砂中的黄金。
仪器

医药
汞的合金和化合物可用于制作补牙材料。但由于汞是一种有毒金属,因此近些年,汞及其化合物在医药工业的使用量大大下降,大多数国家都不再使用汞,而去寻找汞的替代品,以避免汞的毒害作用。
其他工业
汞可以用于制作杀虫剂、防腐剂,但这种药品,容易在满足本身用途时对周围环境造成污染,以至于影响人的身体健康。汞蒸气灯采用气态汞作为原料,气态汞也用于制造日光灯,但由于废弃的灯容易被随意丢弃,破损后灯内的汞逸出会造成大量的环境污染进而影响人体健康,这些以汞为原材料的灯也逐渐被市场抛弃,工厂也不再生产。汞用于制造液体镜面望远镜,科学家们很早就采用液态汞作为反射液体。汞的无机化合物可用作颜料、涂料等,用于绘画、化妆品和印刷业等方面,2022年前后比如美国的明尼苏达州等地已经开始禁止向化妆品中添加汞元素,尽管汞可以让化妆品的美白等效果更好,但是长期使用会导致汞元素从皮肤进入人体,超出人体中汞元素的正常含量,对人体的生命健康有着不可估量的破坏作用。
安全事宜
危害
汞是一种有强烈神经毒性的元素,其单质以及多种化合物都有不同程度的毒性,会对环境,动植物,人体等造成巨大的伤害,因而需要正确的防范措施。
短时间内人体吸入大量汞蒸气会引发急性中毒,中毒者会出现头晕、乏力、头疼、睡眠障碍、发热、手指震颤等全身症状。会出现明显的口腔炎症,还可能会有着食欲不振、恶心,腹泻等症状。严重者可发生化学性肺炎。可引起肾脏损伤。
急救措施
皮肤接触
快速脱去受到污染的衣服,用大量的流动清水进行清洗。
眼睛接触
提起眼睑,用大量的流动清水或者生理盐水进行清洗,同时迅速就医。
吸入
迅速离开现场,到新鲜空气处,避免再次吸入受污染的空气,保持自身呼吸道的畅通。如若感觉到呼吸道受阻,需要及时输氧;若呼吸有停止的迹象,要快速进行人工呼吸。及时就医。
食入
消防风险
消防措施
汞本身不会燃烧,参与消防的人员必须穿戴过滤式防毒面具或者隔离式呼吸器、并且穿着全身的防火防毒服,在火源的上风向进行灭火,并尽可能的将贮存有汞的容器移至空旷地带,避免发生二次爆炸等危险情况,尽可能避免生命财产的进一步损失。
汞的泄漏处理与防治措施
泄露紧急处理措施
迅速撤离泄漏污染区的人员至安全区,并及时进行隔离,严格限制出入,避免污染范围进一步扩大。建议应急处理人员佩戴自给正压式呼吸器,穿全身防火防毒服,尽可能切断泄源。
大量泄漏:构筑围堤或挖坑收容。收集回收或运至废物处理场所处置。
处置操作
在处理汞时应当密闭操作,并提供充分的局部排风,采取降温措施。操作人员必须经过专门培训,严格遵守操作规程。建议操作人员佩戴自吸过滤式防毒面具(全面罩),戴化学安全防护眼镜,穿胶布防毒衣,戴橡胶手套。远离易燃、可燃物。防止蒸气泄漏到工作场所空气中。避免与酸类接触。搬运时要轻装轻卸,防止包装及容器损坏。配备泄漏应急处理设备。倒空的容器可能残留有害物,应当及时处理。
贮存操作
将汞储存于阴凉、通风的库房,远离火种、热源。库温不宜超过30℃。同时应与易(可)燃物、酸类等分开存放,切忌混储,尽可能减少安全隐患。另外,储区应备有泄漏应急处理设备和合适的收容材料,以便出现泄漏等事故时可以及时处置,减少人员和财产的损失。
接触防护
空气中的汞含量超标时,必须佩戴自吸过滤式防毒面具。出现紧急情况抢救或者撤离时,应当佩戴空气呼吸器。应注意佩戴化学安全防护眼镜,且穿着胶布防毒衣,佩戴橡胶手套。另外,工作现场禁止喝水、吃饭和吸烟。工作完毕后,要对身体和衣服进行彻底的清洗,并将被污染的衣物单独存放起来,清洗后以备再用,实行就业前和定期的身体检查。
汞的检测方法
预处理
在具体的检测步骤开始之前,对于样品的预处理是必不可少的,它关系着后面检测的精度和准度。下面是几种常用的汞检测前的样品预处理方法。
1.湿法消除
湿法消除是用酸液或者碱液在一定温度下,破坏样品中所含的有机物或者还原性物质的方法。该方法操作简单、易自动化、效率高,但同时不密闭的湿法消除环境会使得汞挥发散失,且方法采用的强氧化剂在操作时也对操作者有着一定的危险性。
2.干法消除
干法消除是通过高温碳化和灰化除去大量有机物,然后用酸或者其他溶剂溶解剩余的样品,并制成试样溶液,最后使用溶剂萃取、掩蔽、沉淀等方法排除其他离子的干扰。该方法试剂用量少,效率高,但汞易挥发,容易造成较大损失且影响结果测定的准确性。
3.微波消除
氢化物发生-原子荧光光谱分析法
氢化物发生-原子荧光光谱法基于下列反应:
NaBH₄+3H₂O+HCl→H₃BO₃+NaCl+8H→EHn+H2↑(过量)
E为可以形成氢化物的元素,m可以等于或不等于n。
反应生成的氢化物被引入到特殊设计的石英炉中,并在此被原子化,受空心阴极灯的光能激发,原子处于基态的外层电子跃迁到高能级,并在回到低能级的过程中以原子荧光的形式辐射出能量,在元素浓度较低的情况下,荧光的强度与原子的浓度成正比。该方法具有操作简单,检出限低,灵敏度高的优良技术特征。
X射线荧光光谱法
X射线荧光光谱法,即让能量以X射线的形式得到释放,内层电子的能量与相近X射线共同照射汞原子核时,内层电子共振吸收X射线的辐射能量后产生跃迁。这种技术方案可以直接地对固体进行测定,不需要进行吸附汞溶出的技术步骤,因此具有稳定的准确性、重现性,减少了分析物的洗脱步骤,减少了试剂消耗和对样本展开处理的时间。


