过渡金属元素(元素周期表中d区与ds区的元素)

VLoG
次浏览
更新时间:2023-05-23
过渡金属元素
元素周期表中d区与ds区的元素

基本信息
| 中文名 | 过渡金属元素 |
| 外文名 | Transition metal elements |
基本简介
物质介绍
过渡金属元素的一个周期称为一个过渡系,第4、5、6周期的元素分别属于第一、二、三过渡系。
族 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 |
第一过渡系 | 21,Sc-钪 | 22,Ti-钛 | 23,V-钒 | 24,Cr-铬 | 25,Mn-锰 | 26,Fe-铁 | 27,Co-钴 | 28,Ni-镍 | 29,Cu-铜 | 30,Zn-锌 |
第二过渡系 | 39,Y-钇 | 40,Zr-锆 | 41,Nb-铌 | 42,Mo-钼 | 44,Ru-钌 | 45,Rh-铑 | 47,Ag-银 | 48,Cd-镉 | ||
第三过渡系 | 71,Lu-镥 | 72,Hf-铪 | 73,Ta-钽 | 74,W-钨 | 75,Re-铼 | 76,Os-锇 | 77,Ir-铱 | 78,Pt-铂 | 79,Au-金 | 80,Hg-汞 |
第四过渡系 | 103,Lr-铹 | 104,Rf-钅卢 | 105,Db- | 106,Sg- | 107,Bh- | 108,Hs- | 109,Mt-钅麦 | 110,Ds-钅达 | 111,Rg-钅仑 | 112,Cn-鎶 |
性质
过渡金属由于具有未充满的价层d轨道,基于十八电子规则,性质与其他元素有明显差别。
由于这一区很多元素的电子构型中都有不少单电子(锰这一族尤为突出,d5构型),较容易失去,所以这些金属都有可变价态,有的(如铁)还有多种稳定存在的金属离子。过渡金属最高可以显+7(锰)、+8(锇)氧化态,前者由于单电子的存在,后者由于能级太高,价电子结合的较为松散。高氧化态存在于金属的酸根或酰基中(如:VO43-钒酸根,VO22+钒酰基)。
对于第一过渡系,高氧化态经常是强氧化剂,并且它们都能形成有还原性的二价金属离子。对于二、三过渡系,由于原子半径大、价电子能量高的原因,低氧化态很难形成,其高氧化态也没有氧化性。同一族的二、三过渡系元素具有相仿的原子半径和相同的性质,这是由于镧系收缩造成的。
铁系元素
铁
(1)氧化数为+2的铁的化合物
硫酸亚铁易溶于水,在水中有微弱的水解,使溶液显酸性;硫酸亚铁被空气氧化,
2FeSO4 + 1/2O2 + H2O 2Fe(OH)SO4
K+ + Fe3+ + [Fe(CN)6]4- KFe[Fe(CN)6]↓普鲁士蓝
2K4[Fe(CN)6] + Cl2 2KCl + 2K3[Fe(CN)6]
4K3[Fe(CN)6] + 4KOH 4K4[Fe(CN)6] + O2 + 2H2O
Fe3+ + SCN- [Fe(SCN)] 2+ (血红色)
(2)氧化数为+3的铁的化合物
2FeCl3 + H2S 2FeCl2 + 2HCl + S
2FeCl3 + SnCl2 2FeCl2 + SnCl4
(3)氧化数为+6的铁的化合物
2Fe(OH)3 + 3ClO- + 4OH- 2FeO42- + 3Cl- + 5H2O
钴和镍
粉红色Co(OH)2被空气氧化为棕褐色Co(OH)3,而绿色Ni(OH)2不被空气氧化。Co(OH)2两性显著,Ni(OH)2碱性。
CoCl2·6H2O粉红 CoCl2·2H2O紫红
CoCl2·H2O蓝紫 CoCl2蓝
易形成配合物,影响氧还性。Co最稳定,Co氧化性很强。但:
2K4[Co(CN)6] + 2H2O 2K3[Co(CN)6] + 2KOH + H2↑
羰基配合物
铁、钴、镍在某些配合物中呈现低氧化态+1,0,-1,-2。羰基配合物是典型。如Ni(CO)4 ,Fe(CO)5,HCo(CO)4。
制备:多数羰基配位物可以通过金属和一氧化碳的直接化合制备,但金属必须是新还原出来的具有活性的粉状物。
Ni + 4CO Ni(CO)4; Fe + 5CO Fe(CO)5
铂系元素
通性
物理性质
金属的密度自左向右增大,到铜族前后,出现密度减小现象。从上到下,原子半径增大,第3过渡系金属密度特别大,重铂金属的密度最大。
熔点、沸点高 熔点最高的单质:钨(W)
硬度大 硬度最大的金属:铬(Cr)
密度大 密度最大的单质:锇(Os)
原子半径
由于过渡金属的d轨道未饱和,对核电荷的屏蔽能力较差,各周期自左向右有效核电荷依次增大,半径依次减小。由于d结构有较大屏蔽作用,到铜族元素前后出现原子半径增大现象。
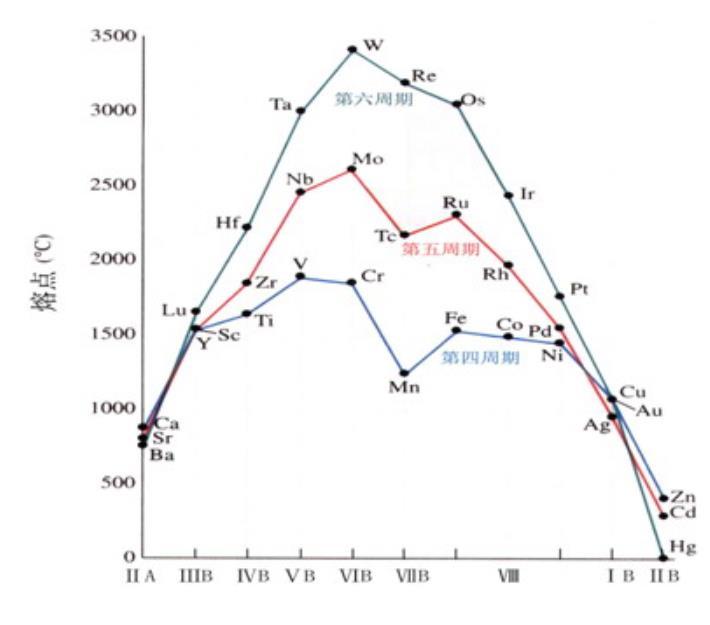
熔点变化
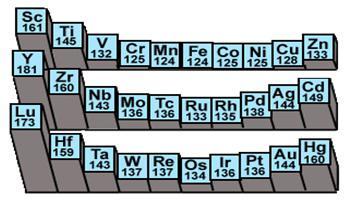
过渡金属元素
氧化态稳定性
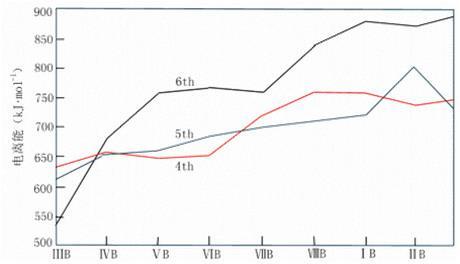
1. 过渡金属的氧化态及其稳定性
氧化态由+2到与族数相同的最高氧化态。同周期从左向右,氧化态先是逐渐升高,但第4周期在锰以后,第5周期在钌以后,第6周期在饿以后,氧化态又逐渐降低,最后与IB铜族元素的低氧化态相同。
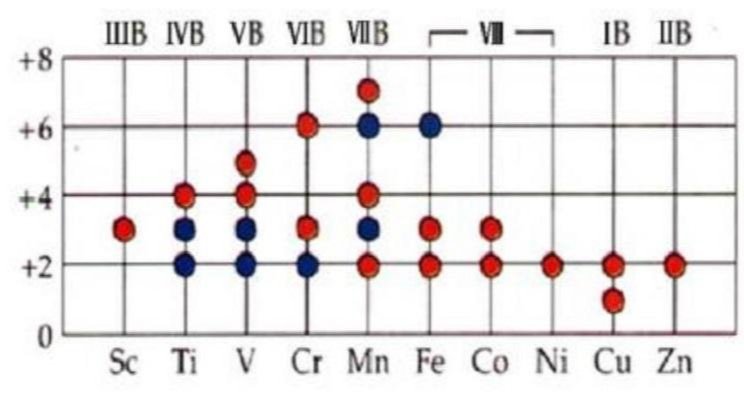
过渡金属元素
第二、三过渡系元素的氧化态-吉布斯自由能图相似,与第一过渡系元素有差别,归因于镧系收缩。第二、三过渡系元素的金属活泼性较差,不易被氧化,ψ˚M+/M一般为正值。随原子序数递增,金属活泼性递减。
同族过渡元素最高氧化态含氧酸ψ˚随周期数增加而略有下降。它们的氧化性随周期数的增加逐渐减弱,趋向于稳定。
颜色
过渡金属的颜色产生于d-d跃迁和电荷跃迁。d的过渡金属化合物主要发生d-d跃迁,d电子组态的过渡金属化合物主要发生电荷跃迁。
Mn (Ⅱ) Fe(Ⅱ) Co(Ⅱ) Ni(Ⅱ) Cu(Ⅱ) Zn(Ⅱ)

过渡金属元素