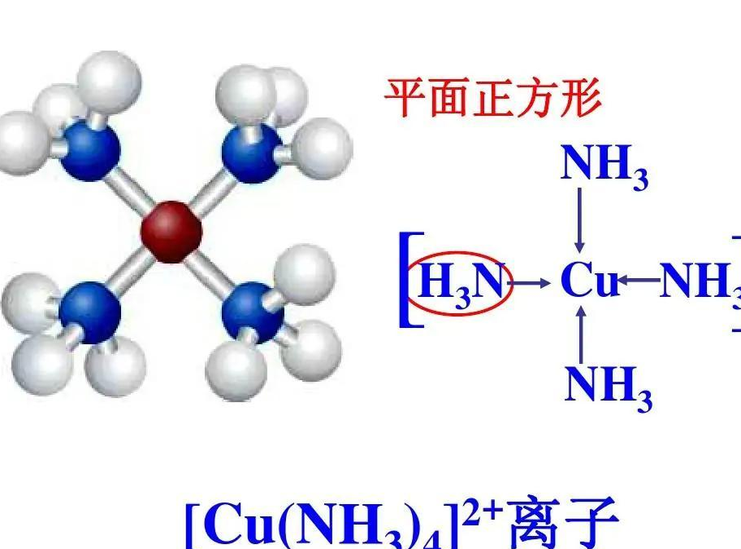
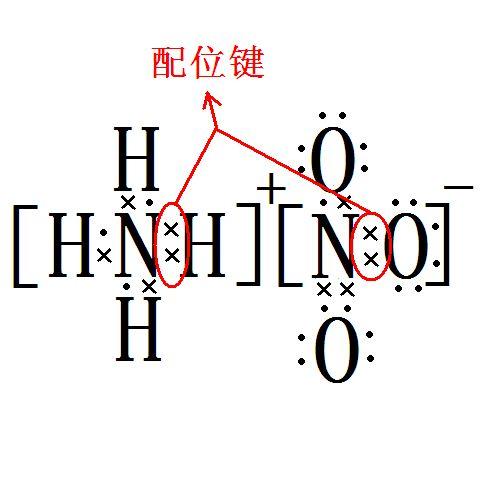
配离子(应用于化学学科的概念)

VLoG
次浏览
更新时间:2023-05-23
基本信息
| 中文名 | 配离子 |
| 外文名 | coordination ion / complexion |
| 存在 | 配位化合物 晶体、溶液等 |
| 电荷数 | 中心 中心 中心 离子和配位体电荷数的代数和 |
电荷数
应用
由于配合物是电中性的,因此,外界离子的电荷总数和配离子的电荷总数相等,而符号相反,所以由外界离子的电荷可以推断出配离子的电荷及中心原子的氧化值。例如, K4[Fe(CN)6]中,外界离子的电荷总数=4x(+1) = +4,所以配离子的电荷为 -4,可以推出中心原子铁的氧化值为Fe( II)。
概念
配位化合物的中心离子与配位体键合形成的具有一定空间构型和特性的复杂离子(或化学质点)即配合物的内界。
可能存在于配位化合物晶体中,也可能存在于溶液中。
组成
配离子由中心原子和配体组成。
配体
配体(ligand,也称为配基)是一个化学名词,表示可和中心原子(金属或类金属)产生键结的原子、分子和离子。一般而言,配体在参与键结时至少会提供一个电子。配体扮演路易斯碱的角色。但在少数情况中配体接受电子,充当路易斯酸。
分类
中心原子
在内界中,能够接受孤对电子的离子或原子统称为中心原子,或称中心离子,位于配位个体的中心位置,是配位个体的核心部分,又称配合物的形成体。
又称配位化合物的形成体或配位化合物的受体。
在某些特定情况下也可以是带正电荷的非金属离子。
中心离子(中心原子)的电荷与半径影响配位化合物的稳定性。
配合物的中心原子一般是带正电荷的阳离子,其中以过渡元素金属离子居多,如铁离子,银离子等;少数高氧化值的非金属元素的原子也可作为中心原子,如 中的B(III)等。而[Ni(Co)4] 、[Fe(Co)5]中的中心原子为Ni、Fe原子;[HCo(Co)4]中的中心原子是Co(- I )。
中心原子的判断
写出结构式,该原子连接两个或两个以上原子,就属于中心原子,该原子只连一个原子,就不是中心原子。如有机物中氢肯定不是中心原子,它只能形成一个键,永远在端点上。一个分子中可能有多个中心原子,如甲醇中,碳、氧均可看作中心原子。