氨(氮氢化合物)

VLoG
次浏览
更新时间:2023-05-23
氨
氮氢化合物
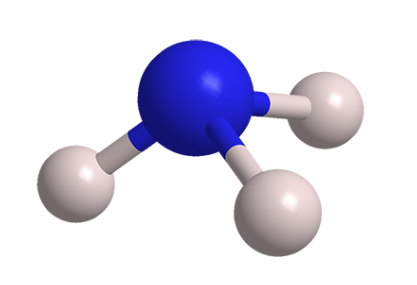
氨(英文名称:Ammonia),无机化合物,由氮和氢组成。化学式为NH3,以液体存在时称为液氨;以气体存在时称为氨气,摩尔质量为17.031g/mol,在标准条件下,密度为0.5971g/cm。氨在常温常压为无色气体,有特殊刺激性臭味,容易被液化,极易溶于水、醇类等溶剂。氨溶解时放出大量热。氨的水溶液呈弱碱性,易挥发。氨可以与无机酸反应,生成各种铵盐,可以用于制造氮肥。氨是一种可燃性气体,与空气或氧气混合到一定浓度时发生爆炸。氨在实验室可由氯化铵和消石灰共热制的,工业上可由氰化法和合成氨法制得。氨在医药上主要用于制造磺胺类药物,农业上主要用于生产氮肥,工业上主要用于生产炸药和各种化学纤维及塑料。
基本信息
中文名
氨
英文名
Ammonia
别名
以液体存在时称为液氨;以气体存在时称为氨气
CAS号
7664-41-7
性质
化学式
NH3
摩尔质量
17.031g/mol
外观
无色气体
气味
特殊刺激性臭味
密度
0.5971g/cm
熔点
78℃
沸点
-33℃
溶解性
极易溶于水
蒸气压
26℃时的蒸气压为1013kPa
危险性
NFPA 704

3-1-0
爆炸极限
空气中的爆炸范围为15.5%~28%,在氧气中为13.5%~82%
自燃温度
630℃
历史
发现
发展
1898年,弗兰克(A.Frank)等人发现碳化钙在氮气中加热到1000℃便可得到氰氨化钙,氰氨化钙与过热蒸汽反应便可得到氨。这种制氨的方法被人们称为氰化法,但这种方法所消耗的能量较高,所以并不经济。
1901年,吕·查得利(Le Chaterlier)在高压、高温的条件下合成了氨,虽然最终发生了爆炸,但开创了高压合成氨的先河。1909年,德国物理化学家弗丽茨·哈伯(Fritz Haber)使用锇为催化剂,在17.5MPa~20.0MPa和500℃~600℃的条件下合成了6%的氨。这成为了氨的合成从实验室到工业化的转折点。1911年,米塔西(Mittasch)成功研究出以铁为活性催化剂来合成氨,这种催化剂比锇作为催化剂廉价,活性高并且耐用。1912年,德国奥堡(Oppau)巴登苯胺纯碱公司建成一个日产30t的合成氨装置,1913年开始运转。
第一次世界大战德国战败后,被迫将合成氨的技术公开。经其他国家在此基础上进行改进后,出现了不同压力的合成氨的方法:低压法(10MPa)、中压法(20MPa~30MPa)和高压法(70MPa~100MPa),但大多数工厂采用的是中压法。
二次世界大战后,由于合成氨的需求量的增加以及石油工业和天然气工业的迅速发展,合成氨的原料逐渐用廉价的天然气、石脑油和重油来代替固体原料(如焦炭)。
氨的来源
自然界中的氨是由动物体和植物腐烂形成的,因为这些物质中含有蛋白质形式的氮。氨也是动物体新陈代谢的副产物,在这种情况下,它形成尿素并排出体外。

氨在人体的代谢
人体内代谢产生的氨和消化道吸收的氨进入血液后形成血氨。在正常生理情况下,血氨的水平在47μmol/L~65μmol/L。在人体内,氨的来源有氨基酸脱氨基、肠道吸收和肾脏产生。氨是有毒的代谢物质,所以机体各组织所产生的氨必须以无毒的形式经血液运输至肝脏合成尿素,然后经肾脏排出,这是体内氨的主要去路(也可以与谷氨酸反应生成谷氨酰胺,重新合成氨基酸,合成其他含氮化合物),或运输至肾脏以铵盐的形式随尿排出体外。氨在血液中有两种运输形式:丙氨酸-葡萄糖循环和谷氨酰胺运氨作用。
结构
氨分子是由一个氮原子和三个氢原子构成,其中氮原子有5个价电子,3个未成对。氮原子采取不等性sp杂化,当它与氢原子化合时,每个氮原子可以和3个氢原子通过极性共价键结合成氨分子,氨分子里的氮原子还有一个孤对电子。由于孤电子对对成键电子对的排斥作用,使N-H键之间的键角∠HNH不是正四面体的109°28′,而是107°,空间结构为三角锥型。这种结构使得氨分子有相当大的极性(偶极矩为5.5×10C·m),易形成氢键。
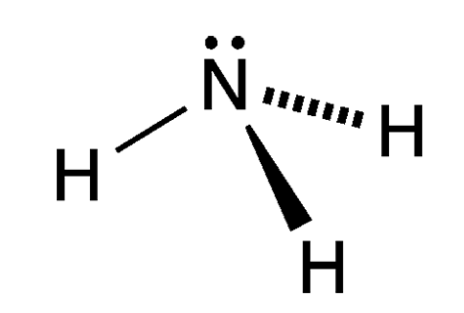
氨的结构式
理化性质
物理性质
常温常压下,氨是一种具有强烈刺激性臭味的无色气体,摩尔质量为17.031g/mol,密度为0.5971g/cm,沸点为-33℃,熔点为78℃。氨极易溶于水、醇类、丙酮、三氯甲烷、苯等溶剂,常温常压下,一体积水可溶解700体积氨,溶解时放出大量热。
氨很容易被液化,在0.1MPa压力下,将氨冷却到-33.5℃,或在常温下加压到0.7~0.8MPa,氨就能液化成无色的液体,同时放出大量的热量。液氨的相对密度为0.667(20℃)。如果人与液氨接触,则会冻伤皮肤。若将液氨在0.101MPa压力下冷却至-77.7℃,就凝结成略带臭味的无色结晶。液氨也很容易气化,降低压力可急剧蒸发,并吸收大量的热。
化学性质
氨对大部分物质没有腐蚀性,但在有水的条件下,对铜、银、锌等金属有腐蚀作用。氨的自燃温度为630℃。氨与空气或氧按一定比例混合后,遇火能爆炸,氨在空气中的爆炸范围为15.5%~28%,在氧气中为13.5%~82%。氨有强烈的毒性,空气中含有0.5%(体积)的氨,就能在几分钟内使人窒息死亡。
自然界中的氨是由动物体和植物腐烂形成的,因为这些物质中含有蛋白质形式的氮。氨也是动物体新陈代谢的副产物,在这种情况下,它形成尿素并排出体外。
高温分解
在高温(800℃以上),氨能分解成氮和氢。

与酸或酸酐反应
氨可以与酸或酸酐反应,生成各种铵盐。





还原性

一氧化氮继续氧化与水可以反应生成硝酸。

Cl2或Br2在常温下也能气态或溶液中把NH3氧化为N2。

若Cl2过量,则生成NCl3。

NH3通过热的CuO也可以被氧化为N2。

NH3与过氧化物或高锰酸盐反应,也均被氧化为N2。

配合物
氨可以提供孤电子对,用作配体生成氨的配合物,如[Ag(NH3)2]、[Cu(NH3)4]。氨能生成各种加成配位化合物,它们和水合物类似,通称氨合物,例如:对应CaCl2·6HO和CuSO4·4H2O也分别有CaCI2·6NH3和CuSO4·4NH3。此等化合物作为配位化合物时,通常称氨络物。
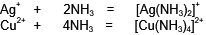
合成氢氰酸、尿素


制备方法
实验室制法
氯化铵与消石灰共热,反应方程式如下:

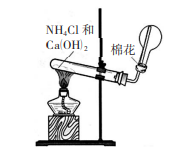
实验室制取氨气反应装置图
工业制法
氰化法
碳化钙在氮气中加热至1000℃得到氰氨化钙,氰氨化钙与过热蒸汽反应生成氨。反应方程式如下:



Haber-Bosch法合成氨
经过了近百年的发展,人们对于H-B法不断改进,如今工业上合成氨是在高温(400°C -500°C) 以及高压 (20MPa-40MPa) 条件下利用Fe/Ru基金属催化剂将N2和H2转化为NH3。但是该方法会消耗大量的能源并且会排放出大量的二氧化碳。
工艺流程
①天然气蒸汽重整制备H2,该过程会消耗大量的化石能源。

②水煤气转化生成更多的H2。

③去除气体中残余的CO和CO2,得到更高纯度的H2。
④将到纯度的N2和H2通入反应装置,利用H-B法制氨。

⑤冷却分离NH3,并回收未反应的N2和H2。
应用领域
医药
农业
氨在国民经济中有着重要意义,现在约有85%的氨用来制造肥料,其余作为生产其他化工产品的原料。除液氨可直接作为肥料外,农业上使用的氮肥,例如尿素、硝酸铵、磷酸铵、硫酸铵、氯化铵、氨水以及各种含氮混肥和复肥,都是以氨为原料的。
工业
氨在工业上主要用来制造炸药和各种化学纤维及塑料。从氨可以制得硝酸,进而再制造硝酸铵、硝化甘油、三硝基甲苯和硝基纤维素等炸药。在化纤和塑料工业中,则以氨、硝酸和尿素等作为氮源,生产己内酰胺、尼龙6单体、己二胺、人造丝、丙烯腈、酚醛树脂和脲醛树脂等产品。在冶金工业中用来提炼矿石中的铜、镍等金属。在制冰、空调、冷藏等系统可以作致冷剂。
安全事宜
安全标识
象形图 |  腐蚀剂 |  急性毒性 |  环境 |
GHS分类
GHS | 危险说明 | 危险等级 |
H221 | 易燃气体 | 易燃气体 |
H314 | 造成严重的皮肤灼伤和眼睛损伤 | 皮肤腐蚀/刺激 |
H331 | 吸入有毒 | 急性毒性,吸入 |
H440 | 对水生生物剧毒 | 对水生环境有害,危害严重 |
储存
储存于阴凉、干燥、通风处。远离火种、热源。防止阳光直射。保持容器密封。应与酸类、金属粉末等分开存放。
泄露处理
氨发生泄露时,人员需迅速撤离泄漏污染区至上风处,并立即进行隔离150m,严格限制出入,切断火源,尽可能切断泄漏源。对泄露污染区合理通风,加速扩散。高浓度泄漏区,喷含盐酸的雾状水中和、稀释、溶解,并构筑围堤或挖坑收容产生的大量废水。如有可能,将残余气或漏出气用排风机送至水洗塔或与塔相连的通风橱内。储罐区最好设稀酸喷洒设施。漏气容器要妥善处理,修复、检验后再使用。
消防处理
消防人员必须穿全身防火防毒服,在上风向灭火,切断气源,若不能切断气源,则不允许熄灭泄漏处的火焰,喷水冷却容器,可能的话将容器从火场移至空旷处。灭火剂可以使用雾状水、抗溶性泡沫、二氧化碳、砂土。
健康危害
低浓度的氨对黏膜有刺激作用,高浓度可造成组织溶解性坏死,引起化学性肺炎及灼伤。轻度急性中毒者表现为皮肤、黏膜的刺激反应,出现鼻炎、咽炎、气管炎和支气管炎;可有角膜和皮肤灼伤。重度者出现喉头水肿、声门狭窄、呼吸道黏膜细胞脱落,气道阻塞而室息,可发生中毒性肺水肿和肝损伤。氨可引起反射性呼吸停止。如氨溅入眼内,可致晶体混浊、角膜穿孔,甚至失明。
急救措施
吸入:迅速脱离现场至空气新鲜处,保持呼吸道通畅,如呼吸困难,应输氧,如呼吸停止,立即进行人工呼吸,就医。
食入:给饮牛奶或催吐,有腐蚀症状时忌洗胃。
眼睛接触:应立即拉下眼脸,用清水或凉开水从眼眶上部流经眼球(避免直接冲击),反复冲洗至少10分钟,就医。
皮肤接触:应立即脱去污染衣物,用大量清水冲洗至少30分钟,严重者再用2%乙酸溶液进行中和或用2%硼酸溶液湿敷就医。


