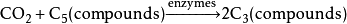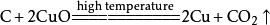二氧化碳(空气中常见的化合物)

VLoG
次浏览
更新时间:2023-05-18
二氧化碳
空气中常见的化合物

基本信息
| 中文名 | 二氧化碳 |
| 沸点 | -57 |
| 别名 | 碳酸酐 干冰 |
| 化学式 | CO₂ |
| 摩尔质量 | 44.0095 g·mol−1 |
展开
基本介绍
二氧化碳

二氧化碳
英文名称 :Carbonic acid gas; carbon dioxide; carbon dioxide; dry ice
别名:碳酸气
EINECS:204-696-9
相对密度:1.101(-37 ℃)
沸点(摄氏度):-56.6(0.52MPa)
熔点(摄氏度):-78.5(升华)
CAS号 :124-38-9
EINECS204-696-9
临界温度31.1℃ 临界压力 7.382MPa
安全术语:
S9Keep container in a well-ventilated place.
保持容器置于良好通风处。
历史沿革
组成结构
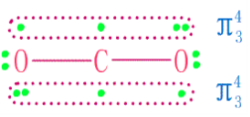
二氧化碳在常温常压下为无色无嗅的气体。CO₂分子有16个价电子,基态为线性分子,属D∞h 点群。CO₂分子中碳氧键键长为116pm,介于碳氧双键(乙醛中C=O键长为124pm)和碳氧三键(CO分子中C≡O键长为112.8pm)之间,说明它已具有一定程度的叁键特性。因此,有人认为在CO₂分子中可能存在着离域的大π键,即碳原子除了与氧原子形成两个键外,还形成两个三中心四电子的大π键。
C原子上两个未参加杂化的p轨道与sp杂化轨道成直角,并且从侧面同氧原子的p轨道分别肩并肩地发生重叠,生成两个∏三中心四电子的离域键。因此,缩短了碳—氧原子间地距离,使CO₂中碳氧键具有一定程度的叁键特征。决定分子形状的是sp杂化轨道,CO₂为直线型分子式。
空气中有微量的二氧化碳,约占0.039%。二氧化碳略溶于水中,形成碳酸,碳酸是一种弱酸。
有关方程
由于碳酸很不稳定,容易分解:

所以,二氧化碳能与水反应形成碳酸:


二氧化碳
如果二氧化碳过量会有:
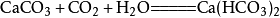
二氧化碳
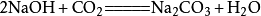
二氧化碳
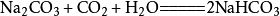
二氧化碳
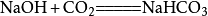
二氧化碳
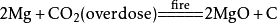
二氧化碳
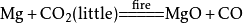
二氧化碳
工业制法:高温煅烧石灰石:
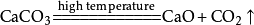
二氧化碳
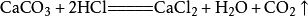
二氧化碳
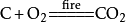
二氧化碳
二氧化碳的固定:
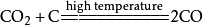
二氧化碳
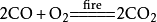
二氧化碳
产生途径
在自然界中二氧化碳含量丰富,为大气组成的一部分。二氧化碳也包含在某些天然气或油田伴生气中以及碳酸盐形成的矿石中。大气里含二氧化碳为0.03~0.04%(体积比),总量约2.75×1012t,主要由含碳物质燃烧和动物的新陈代谢产生。
⑴凡是有机物(包括动植物)在分解、发酵、腐烂、变质的过程中都可释放出CO₂。
⑵石油、石腊、煤炭、天然气燃烧过程中,也要释放出CO₂。
⑶石油、煤炭在生产化工产品过程中,也会释放出CO₂。
⑸所有动物在呼吸过程中,都要吸氧气吐出CO₂。
⑹所有绿色植物都吸收CO₂释放出氧气,进行光合作用。CO₂气体,就是这样,在自然生态平衡中,进行无声无息的循环。
⑺一切工业生产,城市运转,交通等都离不开排放二氧化碳。
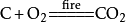
二氧化碳
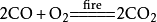
二氧化碳
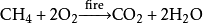
二氧化碳

二氧化碳
所占比重
二氧化碳CO₂平均约占大气体积的387ppm。大气中的二氧化碳含量随季节变化,这主要是由于植物生长的季节性变化而导致的。当春夏季来临时,植物由于光合作用消耗二氧化碳,其含量随之减少;反之,当秋冬季来临时,植物不但不进行光合作用,反而制造二氧化碳,其含量随之上升。二氧化碳常压下为无色、无味、不支持燃烧、不可燃的气体,二氧化碳不供给呼吸。是一种温室气体因为它发送可见光,但在强烈吸收红外线。二氧化碳的浓度于2009年增长了约二百万分之一。
海洋是地表最重要的储水库,也是全球碳的第二大循环系统。通过对海洋循环以及CO₂溶于海水的系统模拟证实,化石燃料燃烧产生的约40%的CO₂会被海洋吸收。海洋中吸收与释放的CO₂的量旗鼓相当。因此,海洋可被视为地球上最大的CO₂水池,其循环回路见图。海洋不仅从大气中吸收CO₂,同时将其自身储存的CO₂释放至大气中,海洋能作为CO₂的存储池也是因为其吸收CO₂的量略大于释放的量。同样由上文所述,海洋中的碳循环系统巨大,是由许多次级系统组成,容易受环境、人类活动和火山喷发等行为影响。该系统也是也是一个耗能结构,通过消耗太阳能使其能耗维持在一个很高的水平。 海洋可被视作从大气中吸收CO₂同时释放出有机碳和碳酸盐沉淀的非线性的动力系统。由于海洋可以储存CO₂并输出CO₂及其盐类,同时缓冲由于大气中CO₂浓度的增加所带来的影响,所以其输入及输出关系是非线性的。该系统是自发循环的,生物处理在这样一个自主的系统中不可或缺。海洋对于CO₂的反馈作用利弊都有,它可以调整大气的CO₂浓度及热平衡。因此研究海洋中CO₂的反应过程至关重要。 如果海洋碳库可被作为一个独立的系统,土地和大气看做是环境,河道和大气中的CO₂及其盐类,以往由于人类活动造成的污染带入的碳类以及化石燃料燃烧和森林砍伐所促成的CO₂及其盐类可认为是系统的碳输入量。因为该系统规模巨大,成分复杂,很难用传统的方法来描述其中的过程。
理化性质
物理性质

二氧化碳
密度比空气略大(1.977g/L,所以实验室收集二氧化碳可用向上排空气法),能溶于水,没有闪点,无色无味。
液体状态表面张力:约3.0dyn/cm
密度:1.816kg/m
粘度:比四氯乙烯粘度低得多,所以液体二氧化碳更能穿透纤维。
二氧化碳分子结构很稳定,化学性质不活泼,不会与织物发生化学反应。
它沸点低(-78.5℃),常温常压下是气体。加压降温可得无色CO₂液体,再降温可得雪花状固体,再压缩可得干冰,干冰达到-78.5℃,会升华成为气体CO₂,不会形成CO₂液体。干冰不是冰,是固态二氧化碳。
化学性质
碳氧化物之一,是一种无机物,不可燃,通常不支持燃烧,无毒性。
和水反应
二氧化碳可以溶于水并和水反应生成碳酸,而不稳定的碳酸容易分解成水和二氧化碳:
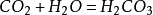
二氧化碳
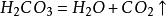
二氧化碳
和碱性物质反应
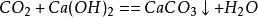
二氧化碳
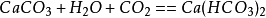
二氧化碳
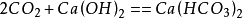
二氧化碳
由于碳酸氢钙溶解性大,可发现沉淀渐渐消失(长时间往已浑浊的石灰水中通入二氧化碳,沉淀消失)。

二氧化碳
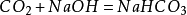
二氧化碳
和活泼金属在点燃下的反应
二氧化碳本身不支持燃烧,但是会和部分活泼金属在点燃的条件下反应(如钠、钾、镁)生成相对应的金属的氧化物和碳:

二氧化碳

二氧化碳
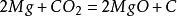
二氧化碳
配伍禁忌
尽管二氧化碳可与多种金属氧化物或还原性金属,如铝、镁、钛和锆发生剧烈的反应,但可与大多数物质配伍。与钠和钾的混合物受震时爆炸。
主要危害
人体危害
二氧化碳密度较空气大,当二氧化碳少时对人体无危害,但其超过一定量时会影响人(其他生物也是)的呼吸,原因是血液中的碳酸浓度增大,酸性增强,并产生酸中毒。空气中二氧化碳的体积分数为1%时,感到气闷,头昏,心悸;4%-5%时感到眩晕。6%以上时使人神志不清、呼吸逐渐停止以致死亡。
因为二氧化碳比空气重,所以在低洼处的浓度较高。以人工凿井或挖孔桩时,若通风不良则会造成井底的人员窒息。CO₂的正常含量是0.04%,当CO₂的浓度达1%会使人感到气闷、头昏、心悸,达到4%~5%时人会感到气喘、头痛、眩晕,而达到10%的时候,会使人体机能严重混乱,使人丧失知觉、神志不清、呼吸停止而死亡。应避免之物质:
各种金属粉尘(例如镁、锆、钛、铝、锰):当悬浮在二氧化碳中易点燃而爆炸。
水:会形成碳酸。
人吸入高浓度的二氧化碳所出现的昏迷及脑缺氧情况,一般大气中二氧化碳含量超过1%时,人即有轻度头晕反应;当超过3%时,开始出现呼吸困难;超过6%时,就会重度缺氧窒息甚至死亡。
中国MAC(mg/m3): | 18000 |
前苏联MAC(mg/m3): | 未制定标准 |
TLVTN: | OSHA 5000ppm,9000mg/m3; ACGIH 5000ppm,9000mg/m3 |
TLVWN: | ACGIH 30000ppm,54000mg/m3 |
监测方法: |
展开表格
中毒反应
二氧化碳的浓度达到1%以上,就会使人头晕目眩。达到4~5%,人便会恶心呕吐,呼吸不畅。超过10%,人便会死亡。
二氧化碳在室外是全球暖化;全球变暖的元凶之一,在室内对人体健康影响及行车安全顾虑更是不容忽视的主因之一。生活当中二氧化碳是人类无时无刻 在制造却经常被忽略的气体,21新世纪大众生活型态的改变,尤其现代人害怕噪音再加上户外空气质量不佳,人们为求隔绝噪音并享受居住空间或办公室空间空调系统带来的舒适便利,长时间将室内窗户密闭以致于室内二氧化碳浓度含量远高于室外平均值,更有医学报导在冷气房内睡觉连续八小时,由于空气有适足对流 有助尘螨滋生,早上会出现鼻塞、皮肤红痒等「病态建筑物症候群」(Sick Building Syndrome)的症状。
·350~450ppm:同一般室外环境
·350~1000ppm:空气清新,呼吸顺畅。
·1000~2000ppm:感觉空气浑浊,并开始觉得昏昏欲睡。
·2000~5000ppm:感觉头痛、嗜睡、呆滞、注意力无法集中、心跳加速、轻度恶心。
·大于5000ppm:可能导致严重缺氧,造成永久性脑损伤、昏迷、甚至死亡。
血清(血浆)中检测CO₂的含量是代谢性酸碱中度的指标之一,基本上代表了血浆中酸碱碱储备的情况。
环境危害
主要是温室效应。因为二氧化碳具有保温的作用,会逐渐使地球表面温度升高。由温室效应所引起的海平面升高,也会对人类的生存环境产生巨大的影响。两极海洋的冰块也将全部融化。所有这些变化对野生动物而言无异于灭顶之灾。
截至2013年5月,地球大气层中的二氧化碳浓度已超过400 ppm(百万分之400)。2000至2009年间的浓度增长率为每年2.0 ppm,且逐年加速。浓度比工业化之前的280 ppm浓度高得多,而人为因素是导致二氧化碳浓度急剧上升的主要原因。释放出的二氧化碳中,57%进入大气层,其余的则进入海洋,造成海洋酸化。
多达四成的地面二氧化碳排放是由于火山爆发。据估计,每年火山爆发释放约130-230万公吨(145-255万吨)二氧化碳到大气中。温泉等也产生大量二氧化碳。在意大利的一个城市,当地的二氧化碳浓度一夜之间上升到75%以上,足以杀死昆虫和小动物,但在白天当阳光照射因为升温相当快,导致气体对流而分散。人类排放的二氧化碳超过火山爆发排放量130倍以上:一年270亿公吨。

二氧化碳的危害
1世纪中叶,全球气温将升高1.5——4.5℃。
海平面升高,也是二氧化碳增多造成的,近100年,海平面上升14厘米,到21世纪中叶,海平面将会上升25——140厘米,海平面的上升,亚马逊雨林将会消失,两极海洋的冰块也将大部分融化。所有这些变化对野生动植物而言无异于灭顶之灾。
空气中一般含有约0.03%二氧化碳,但由于人类活动(如化石燃料燃烧)影响,二氧化碳含量猛增,导致温室效应、全球气候变暖、冰川融化、海平面升高……旨在遏制二氧化碳过量排放的《京都议定书》已经生效,有望通过国际合作遏制温室效应。
预防措施
制取方法
工业制法
高温煅烧石灰石
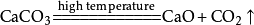
二氧化碳
实验制取
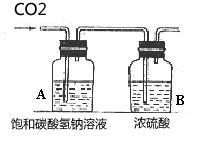
大理石或石灰石和盐酸反应通常需要对气体进行除杂干燥,盐酸反应时会挥发出氯化氢(HCl)气体,所以要通过饱和碳酸氢钠(NaHCO3)溶液除去气体中的氯化氢。溶液中的反应,气体溢出时会带出水蒸气,所以要求严格或必要时要对气体进行干燥,通常用装有浓硫酸的洗气瓶进行干燥。由于二氧化碳密度比空气大,易溶于水,所以采用向上排空气法。
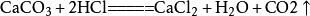
二氧化碳
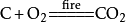
二氧化碳
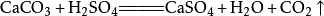
二氧化碳
另外,不能用碳酸钠和盐酸反应制取,因为反应速率太快,不易收集;不能用碳酸钙和浓盐酸反应,因为浓盐酸易挥发出大量氯化氢气体,使碳酸氢钠无法完全去除,制得的二氧化碳纯度会下降;也不能用碳酸钙和稀硫酸反应收集,因为反应会生成难溶的硫酸钙,硫酸根会附着在碳酸钙表面,使碳酸钙无法与酸接触,影响反应的继续。附:
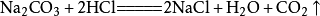
二氧化碳
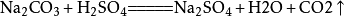
二氧化碳
(上文实验室不适用的三种方法)
化学诗歌
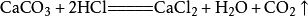
二氧化碳
解释:
title
2、两种苏打皆不用,速度太快控制难:“两种苏打”特指苏打(Na₂CO₃)和小苏打(NaHCO₃)。这两句的意思是说不能用Na₂CO₃和NaHCO₃代替CaCO₃跟盐酸反应来制取CO₂,是因为Na₂CO₃和NaHCO₃跟盐酸反应的速度太快,产生的CO₂很快逸出,不易控制,也不便于操作。
4、镁盐不如钙盐廉:“镁盐”指MgCO₃;“钙盐”指CaCO₃,意思是说不能用MgCO₃代CaCO₃,因为虽然MgCO₃跟盐酸与CaCO₃跟盐酸反应相似,但由于MgCO₃的来源较少,不如CaCO₃廉价易得。
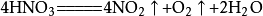
二氧化碳
民间制法
小苏打(碳酸氢钠)和白醋反应
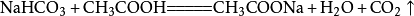
二氧化碳
临界萃取
现国内外正在致力于发展一种新型二氧化碳利用技术── CO₂超临界萃取技术。运用该技术可生产高附加值的产品,可提取过去用化学方法无法提取的物质,且廉价、无毒、安全、高效。它适用于化工、医药、食品等工业。
二氧化碳在温度高于临界温度(Tc)31℃、压力高于临界压力(Pc)3MPa的状态下,性质会发生变化,其密度近于液体,粘度近于气体,扩散系数为液体的100倍,因而具有惊人的溶解能力,用它可溶解多种物质,然后提取其中的有效成分,具有广泛应用。
传统提取有效成份的方法如水蒸汽蒸馏法、减压蒸馏法、溶剂萃取法等,但工艺复杂、纯度不高,而且易残留有害物质。而二氧化碳超临界萃取廉价、无毒、安全、高效,可以生产极高附加值的产品。用超临界CO₂萃取法可以从许多种植物中提取其有效成分,而这些成分过去用化学方法是提取不出来的。除了用在化工、化工等工业外,还可用在烟草、香料、食品等方面。如食品中,可以用来去除咖啡、茶叶中的咖啡因,可提取大蒜素、胚芽油、沙棘油、植物油以及医药用的鸦片、阿托品、人参素、虾青素(英文称astaxanthin,简称ASTA)及银杏叶、紫杉中的有价值成分。以下举例简单介绍一下该技术的应用。
提取辣椒中的红色素
用超临界方法萃取的红色素没有一丝辣味,副产品主要是辣味素,只要加入90%的熟植物油即可制成辣椒油。一年能收回投资。1991年以来,在日本每年需要辣椒红色素30吨,每公斤价3万日元,年销售额9亿日元。中国化学方法生产的辣椒红色素每年60吨,但色价太低又有辣味,出口困难。中国色素应用也呈直线上升趋势,因此生产色素有极光明的前景。除辣椒色素外,设备还可使用于红花色素、虾青素等。
提取茶叶中的茶多酚
安徽、云南、四川、湖北等省盛产茶叶,可以将质次的碎茶叶末或次茶生产茶多酚及咖啡因。茶多酚是极优良的抗氧化剂,广泛用于食品和化妆品等方面,已发现茶多酚有抗龋杀菌作用,在医学方面茶多酚可以有降胆固醇、降血压、降血脂、延缓衰老作用,因此是一种优良的天然食品添加剂。用化学方法提取的茶多酚比不上用CO₂超临界萃取法生产的茶多酚纯净,因此在大量种植茶叶的地区上此项目,一定有较大的经济效益。此外咖啡因也是常用的药品,这将使过去认为无用的次品,转变成高附加值的产品。100吨茶叶末可以提取5吨茶多酚,产值近千万元。
提取银杏黄酮、内酯
用超临界萃取设备杏从银可粗提物中精提银杏黄酮、内酯。银杏叶粗提物成本年需2000万元,超临界萃取设备工艺投资300万元,产值就可达到2900万元。一年内可收回投资并有600万元收益,第二年可获毛利900万元。
提取桂花精和米糖油
如用超临界萃取技术提取桂花精油,每千克油在国际市场上售价可达3000美元。一瓶25mL装的香水只需桂花精油5~6滴。由超临界流体浸制的米糠油是一种相当纯的天然高品质油。米糠油中所含的甾醇(高达0.75%)可化学合成甾醇激素,其产品包括:雄性荷尔蒙、雌性荷尔蒙、避孕药、利尿剂、抗癌剂。这些产品在医药工业中占有重要的地位和极高的经济价值。甾族药物的生产,在世界范围内是一个40亿美元的产业,而米糠油是合成甾醇药的最佳原料。
国外在生产香精和啤酒花方面已采用了CO₂超临界萃取技术。中国有丰富的自然资源,超临界萃取技术有极大的推广价值。有些交通不发达的山区,特产资源十分丰富,尤其盛产中草药材。处理这些药材,要用相当大的装置,且运输不便,如能在这些山区建立CO₂超临界萃取设备,可用以提取中药中最为有用的精华部分,这不仅减少了大量的运输成本,而且极大地增加了中药的附加值,可开发生产出更多的医药新产品。五超临界CO₂流体提取虾青素的工艺研究。
用超临界 CO₂流体萃取技术从虾壳中提取虾青素,通过试验得到最佳萃取工艺参数为萃取压力40MPa,萃取温度60℃提取率可达到805%,皂化反应KOH的浓度为100mg/mL,反应时间是3h,通过液相色谱分离技术可以得到高纯度的虾青素。
虾青素(astaxanthin)是一种天然的油溶性色素在食品添加剂、水产养殖、化妆品、保健品和医药工业方面有广阔的应用前景[1~6]。虾青素的提取方法很多,如乙醇提取、丙酮提取、二氯甲烷提取等但这些方法存在有机溶剂残留,对人体健康造成伤害。超临界CO₂流体提取法操作简便无环境污染。(见扩展阅读)六采用CO₂超临界萃取技术可利用的资源。国内外采用CO₂超临界萃取技术可利用的资源有:紫杉、黄芪、人参叶、虾青素、大麻、香獐、青蒿草、银杏叶、川贝草、桉叶、玫瑰花、樟树叶、茉莉花、花椒、八角、桂花、生姜、大蒜、辣椒、桔柚皮、啤酒花、芒草、香茅草、鼠尾草、迷迭香、丁子香、豆蔻、沙棘、小麦、玉米、米糠、鱼、烟草、茶叶、煤、废油等。北京、山东、湖南、广西、浙江、江苏、湖北(荆州市天然虾青素有限公司)等地的一些科研所、院校和医药、食品企业都在积极进行超临界萃取技术的研究应用,并取得了一批可喜的成果。中科院广州化学研究所与南方面粉集团联合设计、制造、安装的200L大型超临界和工业试验装置,作为“八五”国家科技投资项目,已于1996年1月24日通过国家科委组织验收,正式投入运行。
加工方法
目前最普遍的干洗技术是采用烃类(石油类)、氯代烃(如四氯乙烯)作为溶剂。但石油溶剂闪点低,易爆易燃,干燥慢;氯代烃气味刺鼻,毒性较高(一般在空气中的含量限制在50ppm以下)。干洗行业特别是欧美一些国家一直在寻找一种既清洁卫生安全高效的洗涤溶剂,煤炭最新推出的有绿色大地(Greenearth)、RYNEX、以及液体二氧化碳等新型清洗剂。Greenearth是一种清澈无味的液体,KB值(洗净率)与石油溶剂接近,但低于四氯乙烯,而且价格昂贵;RYNEX的KB值与四氯乙烯差不多,但含水量较高,而且蒸发太慢,不容易再生和回收,干洗周期长;液体二氧化碳KB值比石油溶剂高,略低于四氯乙烯,但在渗色、防污物再凝集等方面比四氯乙烯更好。
衍生产品
聚合材料
一种正在研究的新型合成材料,以二氧化碳为单体原料在双金属配位PBM型催化剂作用下,被活化到较高的程度时,与环氧化物发生共聚反应,生成脂肪族聚碳酸酯(PPC),经过后处理,就得到二氧化碳树脂材料。在聚合中加入其它反应物,可以得到各种不同化学结构的二氧化碳树脂。二氧化碳共聚物具有柔性的分子链,容易通过改变其化学结构来调整其性能;较易在热、催化剂、或微生物作用下生分解,但也可以通过一定的措施加以控制:对氧和其它气体有很低的透过性。可开发出以下用途的产品:1.从脂肪族聚碳酸酯与多异氰酸酯制备聚氨酯材料,优于普通聚酯聚氨酯的耐水解性能。2.用顺丁烯二酸酐作为第三单体进行三元共聚;产物是一种含碳酸酯基和酯基的不饱和树脂,可交联固化,亦能与纤维之类固体复合,是类似于普通不饱和聚酯使用的一种新材料。3.脂肪族聚碳酸酯可以与各种聚合物共混而获得各种不同的性能。可以用作环氧树脂、PVC塑料等的增韧剂、增塑剂或加工助剂。4.二氧化碳、环氧乙烷等的共聚物,二氧化碳、环氧丙烷和琥珀酸酐的三元共聚物能被微生物彻底分解,不留残渣,是一类有希望的生物降解材料。5.二氧化碳共聚物有优异的生物体相容性。特别设计的共聚物可望用作抗凝血材料或用作药物缓释剂。6.某些型耐油橡胶的成本可比用纯丁腈降低10%左右,每吨产品的成本可降低1000元以上。
气体肥料
一定范围内,二氧化碳的浓度越高,植物的光合作用也越强,因此二氧化碳是最好的气肥。美国科学家在新泽西州的一家农场里,利用二氧化碳对不同作物的不同生长期进行了大量的试验研究,他们发现二氧化碳在农作物的生长旺盛期和成熟期使用,效果最显着。在这两个时期中,如果每周喷射两次二氧化碳气体,喷上4~5次后,蔬菜可增产90%,水稻增产70%,大豆增产60%,高粱甚至可以增产200%。
气肥发展前途很大,但目前科学家还难以确定每种作物究竟吸收多少二氧化碳后效果最好。
干冰
介绍
固态二氧化碳压缩后又叫干冰,零下75℃干冰升华,可以吸收周围的热量,使周围水汽凝结,就生成了一种云雾缭绕的景象,同时周围温度迅速降低,因此干冰常用于低温保存物品。
干冰的使用范围广泛,在食品、卫生、工业、餐饮中、人工降雨有大量应用。主要有:
1.干冰在工业模具的应用范围

干冰
干冰清洗益处:干冰清洗可以降低停工工时;减少设备损坏;极有效的清洗高温的设备;减少或降低溶剂的使用;改善工作人员的安全;增进保养效率;减少生产停工期、降低成本、提高生产效率。
2.干冰在石油化工的应用范围
清洗主风机、气压机、烟机、汽轮机、鼓风机等设备及各式加热炉、反应器等结焦结炭的清除。清洗换热器上的聚氯乙烯树脂;清除压缩机、储罐、锅炉等各类压力容器上的油污、锈污、烃类及其表面污垢;清理反应釜、冷凝器;复杂机体除污;炉管清灰等。
3.干冰在食品制药的应用范围
干冰清洗的益处:排除有害化学药剂的使用,避免生产设备接触有害化学物和产生第二次垃圾;拟制或除掉沙门氏菌、利斯特菌等细菌,更彻底的消毒、洁净;排除水刀清洗对电子设备的损伤;最小程度的设备分解;降低停工时间。
4.干冰在印刷工业的应用范围
清除油墨很困难,齿轮和导轨上的积墨会导致低劣的印刷质量。干冰清洗可去除各种油基、水基墨水和清漆,清理齿轮、导轨及喷嘴上的油污、积墨和染料,避免危险废物和溶液的排放,以及危险溶剂造成的人员伤害。
5.干冰在电力行业的应用范围
可对电力锅炉、凝汽器、各类换热器进行清洗;可直接对室内外变压器、绝缘器、配电柜及电线、电缆进行带电载负荷(37kV以下)清洗;发电机、电动机、转子、定子等部件无破损清洗;汽轮机、透平上叶轮、叶片等部件锈垢、烃类和粘着粉末清洗,不需拆下桨叶,省去重新调校桨叶的动平衡。
干冰清洗的益处:使被清洗的污染物有效地分解;由于这些污染物被清除减少了电力损失;减少了外部设备及其基础设备的维修成本;提高电力系统的可靠性;非研磨清洗,保持绝缘体的完整;更适合预防性的维护保养。
6.干冰在汽车工业的应用范围
清洗门皮、蓬顶、车厢、车底油污等无水渍,不会引致水污染;汽车化油器清洗及汽车表面除漆等;清除引擎积碳。如处理积碳,用化学药剂处理时间长,最少要用48小时以上,且药剂对人体有害。干冰清洗可以在10分钟以内彻底解决积碳问题,即节省了时间又降低了成本,除垢率达到100%。
7.干冰在电子工业的应用范围
8.干冰在航空航天的应用范围
9.干冰在船舶业的应用范围
船壳体;海水吸入阀;海水冷凝器和换热器;机房、机械及电器设备等,比一般用高压水射流清洗更干净。
10.干冰在核工业的应用范围
核工业设备的清洗若采用水、喷砂或化学净化剂等传统清洗方法,水、喷砂或化学净化剂等介质同时也被放射性元素污染,处理被二次污染的这些介质需要时间和资金。而使用干冰清洗工艺,干冰颗粒直接喷射到被清洗物体,瞬间升华,不存在二次污染的问题,需要处理的仅仅是被清洗掉的有核污染的积垢等废料。
11.干冰在美容行业的应用范围
有的皮肤科医生用干冰来治疗青春痘,这种治疗就是所谓的冷冻治疗。因为它会轻微的把皮肤冷冻。
有一种治疗青春痘的冷冻材料就是混合磨碎的干冰及乙酮,有时候会混合一些硫磺。液态氮及固态干冰也可以用来作冷冻治疗的材料。冷冻治疗可以减少发炎,前段时间新闻报道刘翔就是用这种冷冻疗法来治疗脸上的青春痘的。这种方法可以减少青春痘疤痕的产生,但并不用来去除疤痕。
12.干冰在食品行业的应用范围
a 在葡萄酒、鸡尾酒或饮料中加入干冰块,饮用时凉爽可口,杯中烟雾缭绕,十分怡人。
b 制作冰淇淋时加入干冰,冰淇淋不易融化。干冰特别适合外卖冰淇淋的冷藏。
13.干冰在冷藏运输领域的应用范围
b 电子低温材料,精密元器件的长短途运输。
c 高档食品的保鲜运输如高档牛羊肉等。
14 、干冰在娱乐领域的应用范围
广泛用于舞台、剧场、影视、婚庆、庆典、晚会效果等制作放烟,如国家剧院的部分节目就是用干冰来制作效果的。
15.干冰在消防行业的应用范围
干冰用来作消防灭火,如部分低温灭火器,但干冰在这一块的应用较少,也即市场程度较低。
干冰使用注意事项:
灭火器
二氧化碳灭火器 的使用方法
部的手柄,另一只手紧握启闭阀的压把。对没有喷射软管的二氧化碳灭火器,应把喇叭筒往上板70-90度。使用时,不能直接用手抓住喇叭筒外壁或金属连线管,防止手被冻伤。灭火时,当可燃液体呈流淌状燃烧时,使用者将二氧化碳灭火剂的喷流由近而远向火焰喷射。如果可燃液体在容器内燃烧时,使用者应将喇叭筒提起。从容器的一侧上部向燃烧的容器中喷射。但不能将二氧化碳射流直接冲击可燃液面,以防止将可燃液体冲出容器而扩大火势,造成灭火困难。
推车式二氧化碳灭火器一般由两人操作,使用时两人一起将灭火器推或拉到燃烧处,在离燃烧物10米左右停下,一人快速取下喇叭筒并展开喷射软管后,握住喇叭筒根部的手柄,另一人快速按逆时针方向旋动手轮,并开到最大位置。灭火方法与手提式的方法一样。
使用二氧化碳灭火器时,在室外使用的,应选择在上风方向喷射。在室外内窄小空间使用的,灭火后操作者应迅速离开,以防窒息。
灭火原理及适用火灾类型
适用于扑救一般B类火灾,如油制品、油脂等火灾,也可适用于A类火灾,但不能扑救B类火灾中的水溶性可燃、易燃液体的火灾,如醇、酯、醚、酮等物质火灾;也不能扑救C类和D类火灾(其主要依靠窒息作用和部分冷却作用灭火)。
二氧化碳在焊接领域应用广泛。
如:二氧化碳气体保护焊,是目前生产中应用最多的方法
舞台中用于制造烟雾。二氧化碳一般不燃烧也不支持燃烧,常温下密度比空气略大,受热膨胀后则会聚集于上方。也常被用作灭火剂但Mg、Na、K等燃烧时不能用CO₂来灭火,因为:
、
、
。
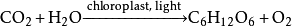
二氧化碳
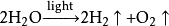
二氧化碳
(水的光解) 、
(递氢)、
(递能) 、
(二氧化碳的固定)、
、
(有机物的生成)
,反应的条件为440℃及800个大气压,在这样的条件下,二氧化碳会形成超流体,能够吸附在钠的表面,加速电子从钠传递至二氧化碳的过程。当温度降低至400℃时,就没有金刚石的产生了,当压力下降时,生成物也主要以石墨为主。
液体二氧化碳密度1.1g/cm³。液体二氧化碳蒸发时或在加压冷却时可凝成固体二氧化碳,俗称干冰,是一种低温致冷剂,密度为1.56克/厘米。二氧化碳能溶于水,20℃时每100体积水可溶88体积二氧化碳,一部分跟水反应生成碳酸。化学性质稳定,没有可燃性,一般不支持燃烧,但活泼金属可在二氧化碳中燃烧,如点燃的镁条可在二氧化碳中燃烧生成氧化镁和碳。二氧化碳是酸性氧化物,可跟碱或碱性氧化物反应生成碳酸盐。跟氨水反应生成碳酸氢铵。无毒,但空气中二氧化碳含量过高时,也会使人因缺氧而发生窒息。绿色植物能将二氧化碳跟水在光合作用下合成有机物。二氧化碳可用于制造碳酸氢铵、小苏打、纯碱、尿素、铅白颜料、饮料、灭火器以及铸钢件的淬火。二氧化碳在大气中约占总体积的0.03%,人呼出的气体中二氧化碳约占4%。实验室中常用盐酸跟大理石反应制取二氧化碳,工业上用煅烧石灰石或酿酒的发酵气中来获得二氧化碳。
固态的二氧化碳(或干冰)在常温下会气化,吸收大量的热,因此可用在急速的食品冷冻。
二氧化碳也可用作焊接用的保护气体,其保护效果不如其他惰性气体(如氩),但价格相对便宜许多。
二氧化碳可用来酿酒,二氧化碳气体创造一个缺氧的环境,有助于防止细菌在葡萄生长。
二氧化碳可控制pH值,游泳池加入二氧化碳以控制pH值,加入二氧化碳从而保持pH值不上升。
二氧化碳可用于制碱工业和制糖工业。
二氧化碳可用于塑料行业的发泡剂。
干冰可以用于人造雨、舞台的烟雾效果、食品行业、美食的特殊效果等。
干冰可以用于清理核工业设备及印刷工业的版辊等。
干冰可以用于汽车、轮船、航空、太空与电子工业。
冷媒
减少二氧化碳这一种温室气体的排放,能有助于减轻地球的温室效应。但二氧化碳同时也是制冷空调行业的天然制冷剂之一,其在制冷行业的广泛使用,恰恰能减少温室效应(GWP=1),还不破坏臭氧层。如此看似矛盾的双重身份,其实一点也不矛盾,但二氧化碳被作为制冷剂使用,已经有百多年的历史了。
而二氧化碳的应用发展也来越成熟,全球零部件与系统供应商,包括丹佛斯、卡乐、恩布拉科、路伟、爱默生以及GMCC美芝等,都顺应了这个潮流,已经为商业部门提供了二氧化碳解决方案。
二氧化碳的研究和应用主要集中于三个方面:一方面是汽车空调领域,由于制冷剂排放量大,对环境的危害也大,必须尽早采用对环境无危害的制冷剂;第二方面是热泵热水器,二氧化碳在超临界条件下放热存在一个相当大的温度滑移,有利于将热水加热到一个更高的温度;第三方面是考虑到二氧化碳良好的低温流动性能和换热特性,采用它作为复叠制冷循环低温级制冷剂。
葡萄糖和油脂
中国科学家团队再次实现二氧化碳“变废为宝”,他们通过电催化结合生物合成的方式,成功将二氧化碳高效还原合成高浓度乙酸,进一步利用微生物可以合成葡萄糖和油脂。这一科研成果由电子科技大学夏川课题组、中国科学院深圳先进技术研究院于涛课题组和中国科学技术大学曾杰课题组共同完成,北京时间2022年4月28日夜间,研究论文在国际专业学术期刊《自然-催化》以封面文章形式发表。
应用领域
二氧化碳可注入饮料中,增加压力,使饮料中带有气泡,增加饮用时的口感,像汽水、啤酒均为此类的例子。
固态的二氧化碳(或干冰)在常温下会气化,吸收大量的热,因此可用在急速的食品冷冻。
二氧化碳的重量比空气重,不助燃,因此许多灭火器都通过产生二氧化碳,利用其特性灭火。而二氧化碳灭火器是直接用液化的二氧化碳灭火,除上述特性外,更有灭火后不会留下固体残留物的优点。
二氧化碳激光是一种重要的工业激光来源。
液体二氧化碳通过减压变成气体很容积和织物分离,完全省去了用传统溶剂带来的复杂后处理过程。液体CO₂和超临界CO₂均可作为溶剂,尽管超临界CO₂具有比液体CO₂更高的溶解性(具有与液体相近的密度和高溶解性,并兼备气体的低粘度和高渗透力)。但它对设备的要求比液体CO₂高。综合考虑机器成本与作CO₂为溶剂,温度控制在15℃左右,压力在5MPa左右。
2023年,日本一家饮料制造商计划推出一种能吸收周围空气中二氧化碳的自动售货机,以助力减少碳足迹。
药用功能
药理
低浓度时为生理性呼吸兴奋药。当空气中该品含量超过正常(0.03%)时,能使呼吸加深加快;如含量为1%时,能使正常人呼吸量增加25%;含量为3%时,使呼吸量增加2倍。但当含量为25%时,则可使呼吸中枢麻痹,并引起酸中毒, 故吸入浓度不宜超过10%。
适应症
临床多以该品5~7%与93~95%的氧混合吸入, 用于急救溺毙、吗啡或一氧化碳中毒者、新生儿窒息等。乙醚麻醉时,如加用含有3~5% 该品的氧气吸入,可使麻醉效率增加,并减少呼吸道的刺激。
用法用量
遵医嘱。25%高浓度吸入可使呼吸中枢麻痹,引起酸中毒。吸入浓度不超过10%。
不良反应
25%高浓度吸入可使呼吸中枢麻痹引起酸中毒.吸入浓度不超过10%。
二氧化碳导致呼吸性中毒
⑴低浓度的二氧化碳可以兴奋呼吸中枢,便呼吸加深加快。高浓度二氧化碳可以抑制和麻痹呼吸中枢。
临床上很少见单纯的二氧化碳中毒,由于空气中二氧化碳增多,常伴随氧浓度降低。比如:地窖中储存的蔬菜、水果呼吸时产生二氧化碳,同时消耗了氧气。无防护措施进入地窖所发生之中毒,是高浓度二氧化碳和缺氧造成的。试验证明氧充足的空气中二氧化碳浓度为5%时对人尚无害;但是,氧浓度为17%以下的空气中含4%二氧化碳,即可使人中毒。缺氧可造成肺水肿、脑水肿、代谢性酸中毒、电解质紊乱、休克、缺氧性脑病等。
测定方法
节选自国家标准《公共场所空气中二氧化碳测定方法 GB/T 18204.24-2000》
1、范围
本标准规定了公共场所空气中二氧化碳浓度的测定方法。
本标准适用于公共场所空气中二氧化碳浓度的测定。
第一法不分光红外线气体分析法
2、 原理
二氧化碳对红外线具有选择性的吸收。在一定范围内,吸收值与二氧化碳浓度呈线性关系。根据吸
收值确定样品中二氧化碳的浓度。
3、 试剂和材料
3.2无水氯化钙D分析纯。
3.3 高纯氮气D纯度99.99%。
3.4烧碱石棉D分析纯。
4、 仪器和设备
4.1 二氧化碳不分光红外线气体分析仪
4.2 仪器主要性能指标如下:
测量范围0-0.5%;0-1.5%两档。
重现性≦±1%满刻度
零点漂移:≦±3%满刻度/4h
跨度漂移:≦±3%满刻度/4h
一氧化碳干扰:1000ml/m3(1000 ppm)co≤±2%满刻度。
启动时间:30min
抽氧流量:>0.5L/min
响应时间D指针指示到满刻度的90%的时间<15s。
二氧化碳—挥发油的测定—挥发油测定法。
应用范围:
该方法采用挥发油测定法测定二氧化碳中挥发油的含量。
方法原理:
试剂:
无特殊试剂
仪器设备:
二氧化碳吸收器:1000mL(或500mL、2000mL)的硬质圆底烧瓶,上接挥发油测定器,挥发油测定器的上端连接回流冷凝管。以上各部均用玻璃磨口连接。测定器应具有0.1mL的刻度。全部仪器应充分洗净,并检查接合部分是否严密,以防挥发油逸出。
注:装置中挥发油测定器的支管分岔处应与基准线平行。
试样制备:
操作步骤:
称取供试品粉末(过二~三号筛,24—50目)适量(约相当于含挥发油0.5~1.0mL) (准确至0.01g)置烧瓶中,加水300~500mL与玻璃珠数粒,振摇混合后,连接挥发油测定器与回流冷凝管。自冷凝管上端加水使充满挥发油测定器的刻度部分,并溢流入烧瓶时为止。置电热套中或用其他适宜方法缓缓加热至沸,并保持微沸约5小时,至测定器中油量不再增加,停止加热,放置片刻,开启测定器下端的活塞,将水缓缓放出,至油层上端到达刻度0线上面5mm处为止。放置1小时以上,再开启活塞使油层下降至其上端恰与刻度0线平齐,读取挥发油量,并计算供试品中挥发油的含量(%)。
参考文献:
中华人民共和国药典,国家药典委员会编,化学工业出版社,2005年版,一部p.12。
统计数据
2014年年4月北半球大气中月均二氧化碳浓度首次超过400ppm(1ppm为百万分之一)。
这一现象可视为温室气体水平不断升高的另一警告,必须采取紧急行动遏制新增温室气体排放。
自2012年以来,加拿大、美国、挪威和芬兰位于北极圈内观测站的记录显示春季月平均二氧化碳浓度已超400ppm,但北半球更低纬度的观测站记录也显示出该趋势。
世界气象组织位于佛得角、德国、爱尔兰、日本、西班牙与瑞士的观测站均报告说,2012年3月至4月记录的月均二氧化碳浓度超过400ppm。
2014年年4月,世界气象组织全球大气观测网中,所有位于北半球的观测站监测到的二氧化碳浓度均创当地春季最高值。2012年全球年均大气二氧化碳浓度为393.1ppm, 而工业化以前是278ppm。
发展状况
二氧化碳相关方程式
2、甲烷在空气中燃烧:CH4+2O2点燃CO₂+2H2O
6、二氧化碳通过澄清石灰水(检验二氧化碳):Ca(OH)2+CO₂====CaCO3↓+H2O
7、氢氧化钠和二氧化碳反应(除去二氧化碳):2NaOH+CO₂====Na2CO3+H2O
8、石灰石(或大理石)与稀盐酸反应(二氧化碳的实验室制法):CaCO3+2HCl===CaCl2+H2O+CO₂↑
9、碳酸钠与浓盐酸反应(泡沫灭火器的原理):Na2CO3+2HCl===2NaCl+H2O+CO₂↑
C+O2点燃====CO₂现象:生成能使纯净的石灰水变浑浊的气体
Ca(OH)2+CO₂===CaCO3↓+H2O现象:生成白色的沉淀,用于检验二氧化碳
CaCO3+CO₂+H2O===Ca(HCO3)2现象:白色固体逐渐溶解
Ca(HCO3)△====CaCO3↓+CO₂↑+H2O现象:生成白色的沉淀,同时有能使纯净的石灰水变浑浊的气体生成
Cu2(OH)2CO3△====2CuO+H2O+CO₂↑现象:固体由绿色逐渐变成黑色,同时有能使纯净石灰水变浑浊的气体生成
跟一氧化碳有关的,但同时也跟二氧化碳有关:
Fe3O4+4CO====3Fe+4CO₂现象:固体由黑色变成银白色,同时有能使纯净石灰水变浑浊的气体生成
高温
FeO+CO===Fe+CO₂现象:固体由黑色逐渐变成银白色,同时有能使纯净石灰水变浑浊的气体生成
高温
Fe2O3+3CO====2Fe+3CO₂现象:固体由红色逐渐变成银白色,同时有能使纯净石灰水变浑浊的气体生成
高温
CuO+CO====Cu+CO₂现象:固体由黑色变成红色,同时有能使纯净石灰水变浑浊的气体生成
研究成果
2022年10月10日,齐鲁网·闪电新闻记者从曲阜师范大学获悉,该校化学与化工学院赵育磊副教授与蒋原野副教授合作,在二氧化碳利用领域取得突破性进展,相关研究成果发表在国际顶级期刊《德国应用化学》(Angewandte Chemie International Edition)上,论文题为“Transient Stabilization Effect of CO2 in the Electrochemical Hydrogenation of Azo Compounds and the Reductive Coupling of α-Ketoesters” (DOI: 10.1002/anie.202213636。
2023年1月3日,据科技日报消息,内蒙古大学科研团队在探索新型电催化二氧化碳还原材料领域取得重要突破。相关成果发表于国际能源类期刊《先进能源材料》。
中国科学院空天信息创新研究院遥感卫星应用国家工程研究中心石玉胜研究团队在燃煤电厂二氧化碳排放的遥感反演估算研究方面取得进展。相关研究成果在线发表在环境科学与生态学期刊《清洁生产》。
中国科学院空天信息创新研究院科研团队通过大气传输模型模拟,结合地基观测和卫星数据验证,实现量化全球火灾碳排放对大气二氧化碳浓度影响,相关研究成果论文在国际专业学术期刊《总体环境科学》(Science of the Total Environment)在线发表。
参考资料
[1]
中国科学家再次实现二氧化碳“变废为宝”:还原合成葡萄糖和油脂 · 新浪网[引用日期2022-04-29]
[2]
冬奥科普丨从“牛奶刨冰”到低碳环保,滑冰场的奇怪知识又增加了2022-02-07T16:55:14+08:00[引用日期2022-05-17 18:01:43]
[3]
「提醒」这些绿植真能吸甲醛!然而更有用的是…2019-05-27T18:10:55+08:00[引用日期2022-05-17 18:10:38]
[4]
内蒙古发展富碳农业 催生第三次农业革命2017-07-08T20:50:34+08:00[引用日期2022-05-17 18:10:59]
[5]
一氧化碳中毒和二氧化碳中毒有什么区别?哪些场景容易发生?2021-03-26T21:13:47+08:00[引用日期2022-05-17 18:13:09]
展开
相关合集

医疗气体分类
共4个词条1553阅读

氮气
氮元素形成的一种单质

氦气
无色无味的惰性稀有气体

二氧化碳
空气中常见的化合物
查看更多
相关视频
全部
808次播放04:04
为什么二氧化碳可以用来灭火?