亚硝酸(N(III)对应的含氧酸)

VLoG
次浏览
更新时间:2023-05-16
亚硝酸
N(III)对应的含氧酸
基本信息
| 中文名 | 亚硝酸 |
| 外文名 | Nitrous acid |
| 气味 | 有刺激性气味 |
| 外观 | 无色液体 |
| 安全术语 | S:S1/2 S23 S26 S36 S45 |
展开
概述
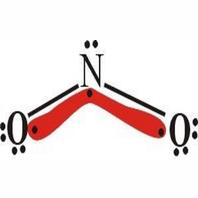
结构
分子式:HNO2
分子量:47.013
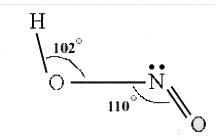
键长:N—OH为143pm,N—O为118pm。
键角:HON为102°,ONO为111°。
理化性质
物理性质
外观与性状:无色液体。
密度:1.54±0.1 g/cm3(Predicted)
化学性质
弱酸性
HNO2↔ H+ NO2
NaNO2+ H2SO4= NaHSO4+ HNO2
亚硝酸是比醋酸稍强的弱酸,它的电离平衡常数为4.6x10。亚硝酸溶液遇微热即分解:
2HNO2= NO + NO2+ H2O
氧化性
酸性溶液中HNO2的ψθ值:
HNO2+ H+ e↔ NO + H2O ψθ= +0.99V
NO3+ 4H+ 3e↔ NO + 2H2O ψθ= +0.95V
2HNO2+ 2I+ 2H→ 2NO + I2+ 2H2O
还原性
NO2+Cl2+ H2O → NO3+ 2H+ 2Cl
在碱性溶液中NO2的还原性是主要的,空气中的氧就能把NO2氧化成NO3。
碱性溶液中NO2和O2的ψθ值如下:
NO3+ H2O + 2e↔ NO2+ 2OHψθ=+0.01V
NO2+ H2O +e↔ NO + 2OHψθ =-0.46V
O2+ 2H2O + 4e↔ 4OHψθ =+0.401V
2NO2+ O2→ 2NO3
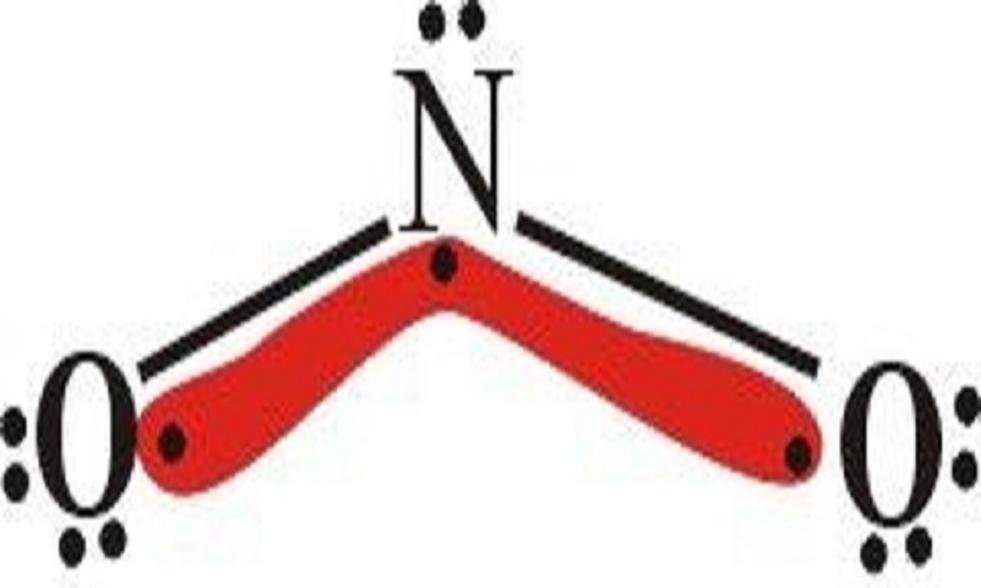
易生成配位化合物
在NO2离子中,N原子和O原子上都有孤电子对,它们能分别与许多过渡金属离子生成配位键,形成配位化合物,例如[Co(NO2)4]3和[Co(NO2)(NH3)5]2等,它与K离子生成黄色的K3[Co(NO2)6]沉淀、此方法可用于鉴定K离子的存在:
3K+ [Co(NO2)6]→ K3[Co(NO2)6]↓(黄色)
热稳定性
亚硝酸盐具有很高的热稳定性,可用金属在高温下还原硝酸盐的方法来制备亚硝酸盐:
结构
化学反应
3HNO2→HNO3+H2O+2NO
2、氧化还原标准电极电势为:
NO2(g)+H++e-=HNO2,E°=1.093V(还原剂)
HNO2+H++e-=NO(g)+H2O,E°=0.996V(氧化剂)
5、脂肪仲胺和芳香仲胺与亚硝酸反应生成N-亚硝基胺,其是不溶于水的黄色油状物或固体。
6、脂肪叔胺和亚硝酸只形成不稳定的盐。
制备方法
检验
用途
鉴定试剂
制作火药
硝酸钾是制黑色火药的原料。
危害及处理
亚硝酸
慎重选购:消费者应少购温室里生长的“反季节蔬菜”。这种蔬菜营养低、口味差,硝酸盐含量高,过多食用有损健康。应注意选购本地生长的蔬菜。一般来讲,经长途贩运而来的蔬菜,所含的硝酸盐往往会成倍增多,要多食根茎和瓜果类蔬菜。
减害处理:对不放心的蔬菜,在食用前应作一定的减害处理,如日晒、漂洗和浸泡等。这些方法是降低菜体内残留硝酸盐的有效方法。
相关合集

含氮的含氧酸
共3个词条310阅读

硝酸
六大无机强酸之一
亚硝酸
N(III)对应的含氧酸
次硝酸
次硝酸,分子式为HNO,是氮的一种含氧酸,属于弱酸。次硝酸常作为反应中间体。
查看更多
相关视频
全部
3834次播放03:02
亚硝酸盐中毒,该如何急救?这三点一定要记住,速看|生活圈