乙炔(最简单的炔类)

VLoG
次浏览
更新时间:2023-05-19
乙炔
最简单的炔类
乙炔-结构式
乙炔,一种有机化合物,是最简单的炔烃。英文名:acetylene,俗称电石气。化学式为C₂H₂,分子量为26.04。在常温常压下,纯的乙炔为无色无味的气体,工业制备的乙炔具有刺激性臭味。微溶于水,可溶于丙酮、乙醚等有机溶剂。乙炔官能团为碳碳三键,能与水、卤素等发生加成反应,也能在不同条件下发生聚合反应,可以通过特色反应定性定量地鉴别乙炔。乙炔本身并没有毒性,但在高浓度时会造成窒息,与液态乙炔直接接触会造成冻伤。
基本信息
中文名
乙炔
英文名
acetylene
别名
电石气
CAS编号
74-86-2
性质
化学式
C₂H₂
结构式

摩尔质量
26.04g/mol
外观
无色气体
气味
无味
密度
1.165g/L(gas,0°C,1atm)
熔点
-83.℃(-119°F,升华)
沸点
-83.9℃(-119°F,升华)
蒸气压
44.2atm
危险性
警示术语
R5
安全术语
S9,S16,S33
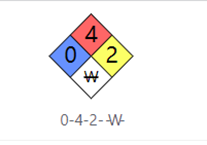
NFPA 704

0-暴露在火中时对人体造成的危害不超过一般可燃物。
4-在大气压和常温下快速蒸发或容易在空气中扩散并容易燃烧的材料。
2-在高温高压下容易发生剧烈化学变化的材料。
w-无水:与水发生剧烈反应或爆炸的材料。
爆炸极限
2.5%-100%
闪点
-17.8℃(0°F)
自燃温度
305°C
工业上普遍使用的乙炔制备方法是电石法,但是电石法能耗大、成本高,许多发达国家已逐步将廉价的天然气作为生产乙炔的原料。乙炔也是合成有机物最重要的原料之一,被广泛应用于纺织、临床、建筑、印刷、农业、冶金等领域。还有研究发现乙炔对环境保护也有一定的意义。
发现历史
乙炔被发现的非常早,1836年,爱尔兰港口城市科克(Cork)皇家学院化学教授戴维·爱德蒙德(Davy,Edmund)在制备金属钾的过程中,将残渣(碳化钾)倒入水中,产生了一种气体并发生爆炸,通过分析确定了这一气体的化学组成是C₂H(采用碳的原子量等于6计算)。
1867年德国有机化学家埃论迈尔(Erlenmeyer,Richard August Carl Emil)确定了乙炔的分子式,并指出其中存在碳碳三键。
化学架构
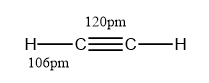
图二:乙炔结构式(由ChemDraw绘制)
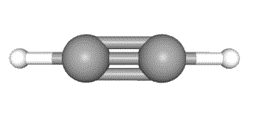
图三:乙炔球棍模型
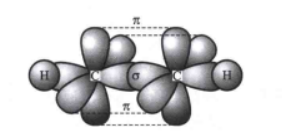
图四:乙炔中的σ键和π键
乙炔分子是直线形结构,碳碳三键的键长为120pm,碳氢键的键长为106pm,碳碳三键与碳氢键的夹角为180°。分子中的两个碳原子都采用sp杂化,彼此各用一个sp杂化轨道沿键轴方向重叠形成碳碳σ键,每个碳原子的另一个sp杂化轨道分别与一个氢原子的1s轨道重叠形成碳氢σ键,每个碳还有两个未参与杂化且互相垂直的p轨道,这些p轨道互相平行,侧面重叠,形成两个相互垂直的π键,两个π键的电子云呈圆柱状对称分布在碳碳σ键周围。而且其中π键由于键能低,很容易被打开。
理化性质
物理性质
纯乙炔在常温常压下为无色无味的气体,电石法制备的乙炔因含有硫化氢、磷化氢等副产物而带有类似大蒜的臭味。乙炔熔点-83.℃(-119°F,升华),沸点-83.9℃(-119°F,升华),密度1.165g/L(gas,0°C,1atm),自燃温度305℃,闪点-17.8℃(0°F),蒸气密度0.91g/cm³(比空气轻),空气中爆炸极限为2.5%-100%。在水中溶解度为1200mg/L(25℃),微溶于乙醇、乙酸、二硫化碳,溶于丙酮、苯,几乎混溶于乙醚。乙炔与水在特定的压力和温度下会生成水合晶体,这种晶体的存在可能会造成乙炔管道的堵塞。
化学性质
亲电加成反应
与卤素加成:乙炔与卤素的加成分布进行,先生成二卤代烃,再加成生成四卤代烃,有时需要加入催化剂,比如FeX₃或SnX₃。
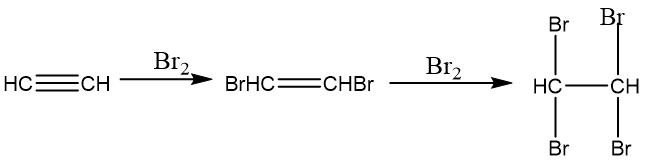
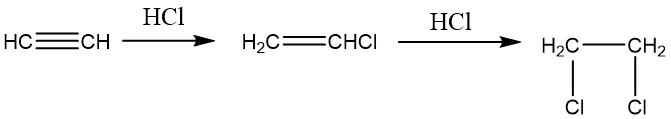
亲核加成反应
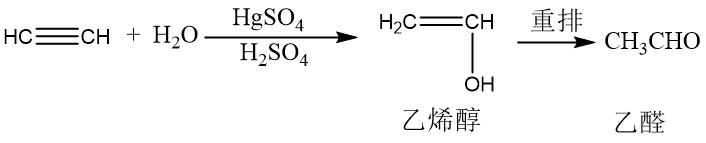
乙炔与醇、酸的亲核加成反应可生成乙烯基醚和羧酸乙烯酯。
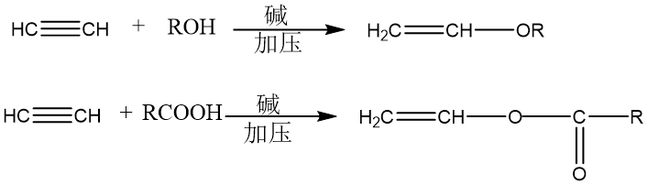
氧化反应
乙炔的氧化反应:
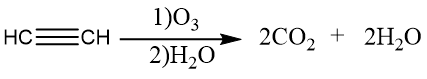
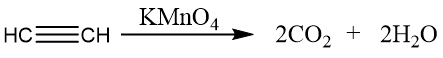
利用乙炔的氧化反应,可以定性检验碳碳三键的存在。
还原反应
乙炔与氢气加成可以得到乙烯,进一步加成可以生成乙烷。根据催化剂的选取可以决定反应进行的程度,采用铂(Pt)、钯(Pd)、镍(Ni)等活性较高的催化剂并且氢气过量时,生成乙烷;若采用活性较低的催化剂(如Lindlar催化剂或P-2催化剂),可部分生成乙烯。
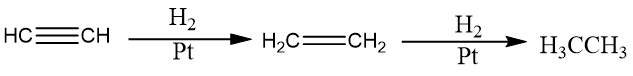
酸性
碳碳三键中的碳原子sp杂化,电负性较大,所以碳氢键的电子云主要位于碳原子周围,使氢原子带正电,易电离,使的乙炔具有酸性(比水弱)。

炔烃的特色反应
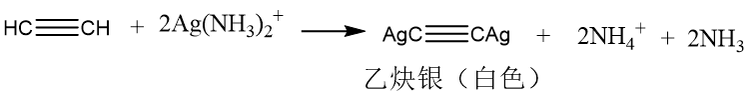
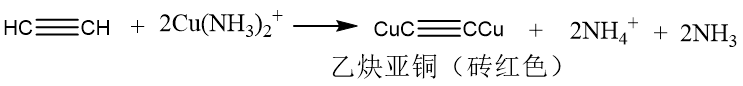
聚合
根据催化剂的不同,乙炔可以发生二聚、三聚、多聚反应。
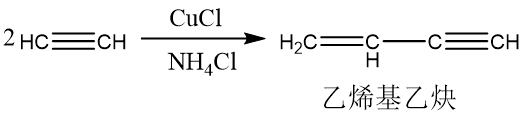
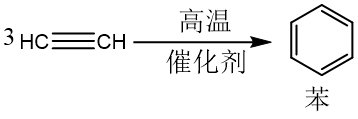
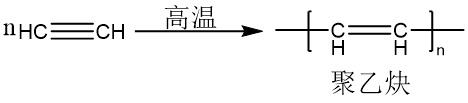
制备方法
电石法
电石法是由电石(CaC₂)与水发生水解反应制得乙炔的方法,反应方程式为:
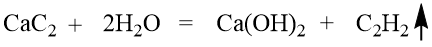
该方法原料易得,但污染严重,能耗高,制得的乙炔副产物较多。
天然气法
部分氧化法
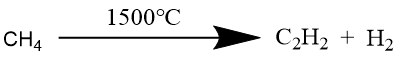
这种方法污染小,产生的副产物(一氧化碳和氢气)可以利用做其他产物原料,且工业上基建投资少,可大规模生产,操作简单。
电弧法
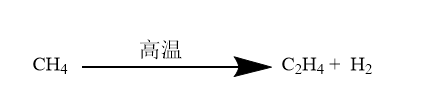
等离子体法
等离子体法是利用等离子体离解天然气制备乙炔的方法。这种方法工艺简单,成本低,安全可靠,无污染,是一种新的,先进的制备乙炔的方法。
应用领域
工业
乙炔在工业方面具有非常广泛的应用前景。乙炔燃烧时能放出大量热,可用于金属焊接和切割,当空气充足时,乙炔充分燃烧并发出明亮的光,可用于照明。由于碳碳三键的存在,乙炔可以用于沉淀金属,特别是铜、银。乙炔化学性质活泼,能与许多试剂发生加成反应,使许多有机物人工合成的重要原料之一。它被用于溶剂、涂料、增塑剂、胶粘剂、合成橡胶改良剂、香料、药物、除草剂的合成,在纺织、农药、临床、建筑、印刷、农业、冶金等领域有广泛的应用。
环境保护
还有研究发现乙炔对环境保护也有一定的作用,比如在生物柴油中添加乙炔,改善了生物柴油的不良性能与燃烧,可明显减少烟雾排放,降低了HC、CO、CO₂的排放量。还有空气中乙炔和氯的混合物在辐照下生成了臭氧,这是除了二氧化氮光解产生臭氧以外,发现的其他产生臭氧的机制之一。
安全事宜
毒理学数据
途径/生物体 | 剂量 | 影响 |
吸入/狗 | 致死浓度(50%):850000ppm | 全身麻痹,呼吸刺激 |
吸入/人体 | 最低毒性浓度:200000ppm/4M | 周围神经和感觉异常,呼吸困难 |
吸入/人体 | 最低致死浓度:50pph/5M | |
吸入/大鼠 | 最低毒性浓度:781111ppm/15M | 全身麻痹 |
吸入/大鼠 | 最低死亡浓度:900000ppm/2H | 全身麻痹,抑制呼吸 |
注:以上数据均来自
火灾危害
乙炔和空气混合时,容易产生爆炸。
健康危害
当乙炔与40%或更多比例的氧气混合时,它可作为一种麻醉剂,吸入后可能会出现头痛,头晕和意识丧失等症状,如果乙炔含量过高,可能会窒息死亡。若皮肤或眼睛接触到乙炔(液体),会造成冻伤,需及时用大量清水冲洗。
防治措施
眼睛接触后,如果眼组织冻结,请立即就医,如果组织没有冻结,立即用大量清水冲洗眼睛至少15分钟,并且频繁眨动眼睛,如果眼睛出现疼痛、肿胀、畏光等不适,请尽快就医。
皮肤接触后,如果出现冻伤,请立即就医,为防止进一步受伤,请不要冲洗或用毛巾擦拭,也不要试图用力脱下冻伤部位的衣服,如果没有冻伤,可以用肥皂和水清洗接触部位皮肤。
如果有人不慎吸入大量乙炔,请快速转移到空气新鲜的地方并拨打急救电话。
应急措施
乙炔发生泄露时,保持通风,将气体浓度保持在爆炸混合物的范围以下并清除所有火源,快速移动至离源头至少800米处;如果发生火灾,应快速移动至离着火点至少1600米处,确保自己安全后,拨打救援电话。
储存和运输
储存
储存于阴凉、干燥、通风良好的地方。保持容器密封,远离所有的火源和氧化性材料,气瓶应直立存放,并牢固固定,防止跌落或被撞倒。可以通过擦拭肥皂水检测乙炔是否泄露以及泄露的准确位置。


