炔烃(不饱合的碳氢化合物)

VLoG
次浏览
更新时间:2023-05-19
物质简介
杂化轨道
分子结构
物理性质
炔烃的熔沸点低、密度小、难溶于水、易溶于有机溶剂,一般也随着分子中碳原子数的增加而发生递变。炔烃在水中的溶解度比烷烃、烯烃稍大。乙炔、丙炔、1-丁炔属弱极性,微溶于水,易溶于非极性溶液中碳架相同的炔烃,三键在链端极性较低。炔烃具有偶极矩,烷基支链多的炔烃较稳定。
化学成分
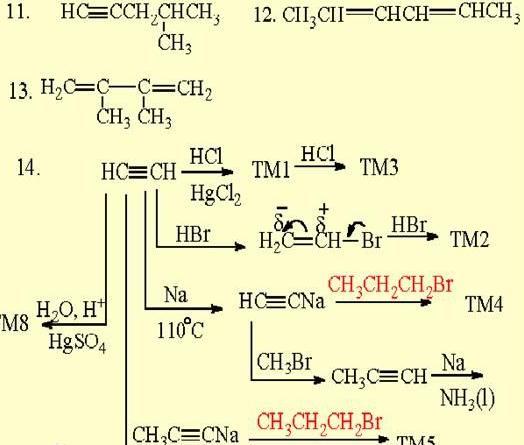
炔烃
重要产品,使乙炔成为基本的有机原料,乙炔的用途已逐渐被乙烯和丙烯代替。最简单的炔烃是乙炔,其结构简式为CH≡CH,分子中4个原子在一直线上,C≡C和C-H的键长分别为1.205埃和1.058埃,比乙烯分子中C=C和C-H的键短。根据量子化学的描述,乙炔分子中两个碳原子以sp杂化轨道互相重叠,再以sp杂化轨道与两个氢原子的1s轨道重叠,共生成三个σ键(一个C-C键和两个C-H键),两个碳原子上各剩下一个2py和2pz轨道,在侧面互相垂直的方向分别重叠,生成两个π键,因此,叁键由一个σ键和两个π键组成。由于C-C呏C-C结构单元中4个碳原子在一条直线上,叁键的存在不会产生几何异构体,叁键碳原子上也不可能有侧链,因此炔烃异构体的数目比含同数碳原子的烯烃少。
化学特性
相对蒸气密度:(空气=1):0.91。
蒸气压(kPa):4053(16.8℃)。闪点<-50℃。
燃烧热:1298.4kJ/mol
键能:837kJ/mol
稳定性和反应活性:不稳定、非常活跃。
避免接触的条件:受热。
简单炔烃的沸点、熔点以及密度,一般比碳原子数相同的烷烃和烯烃要高一些。这是由于炔烃分子较短小、细长,在液态和固态中,分子可以彼此很靠近,分子间的范德华力(vanderWaals作用力)很强。炔烃分子略极性比烯烃强。烯烃不易溶于水,而易溶于石油醚、乙醚、苯和四氯化碳中。一些炔烃的名称及物理性质列入下表:
一些常见炔烃的名称及物理性质
化合物
熔点/℃
沸点/℃
相对密度
乙炔
-82(在压力下)
-82(升华)
—
丙炔
-102.5
-23
—
1-丁炔
-122
8
—
1-戊炔
-98
40
0.695
1-己炔
-124
71
0.719
1-庚炔
-80
100
0.733
1-辛炔
-70
126
0.747
2-丁炔
-24
27
0.694
2-戊炔
-101
56
0.714
2-己炔
-88
84
0.730
3-己炔
-105
81
0.725
化学反应
炔烃
剧烈条件:100°C时,RC≡CR'→RCOOH+R'COOH
CH≡CR→CO2+RCOOH
炔烃中C≡C的C是sp杂化,使得Csp-H的σ键的电子云更靠近碳原子,增强了C-H键极性使氢原子容易解离,显示“酸性”。
电负性:sp>sp2>sp3,酸性大小顺序:乙炔>乙烯>乙烷。
连接在C≡C碳原子上的氢原子相当活泼,易被金属取代,生成炔烃金属衍生物叫做炔化物。
炔与带有活泼氢的有机物发生亲核加成反应:
测定展示
有机分子中的键长可用电子衍射、微波、红外或拉曼光谱予以测定。乙烷、乙烯和乙炔中的碳碳键长和碳氢键长如下
由于杂化碳原子的s成分不同,丙烷、丙烯、丙炔中的碳碳单键的键长是不等长的,s成分越多,碳碳单键的键长越短,随着键长的缩短,原子间的键能将增大。
主要成分:
含量:工业级≥97.5%。
化学特性
化合物
构造式
pKa(近似值)
甲烷(烷烃)
CH4
≈49
乙烯(烯烃)
CH2=CH2
≈40
氨
NH3
34
丙炔(末端炔烃)
CH3C=CH
≈25
乙醇
CH3CH2OH
15.9
水
H2O
15.74
上面的数据表明:末端炔烃的酸性大于末端烯烃,两者又大于烷烃。这是因为轨道的杂化方式会影响碳原子的电负性。一般来讲,杂化轨道中s成分越大,碳原子的电负性就越大,所以在≡C—H中,形成C—H键的电子对比末端烯烃中C—H键和烷烃中的C—H的电子对更靠近碳原子,导致末端炔烃中的C—H键更易于异裂,释放出质子,因而末端炔烃的酸性比末端烯烃和烷烃强。所以,它们可与强碱反应形成金属化合物,称为炔化物。
乙炔一钠中的氢还可以和碱继续反应,生成乙炔二钠。二者皆为弱酸盐,与水作用很快即水解成乙炔和氢氧化钠,但乙炔二钠比乙炔一钠更为激烈,几乎是爆炸性的。乙炔一钠是制备一元取代乙炔,也叫做末端炔烃的重要原料。
与烷烃不同,炔烃不稳定并非常活跃,因此乙炔燃烧发出大量的热,乙炔焰常用来焊接。
制备
炔烃也可以由醛通过Corey-Fuchs反应制得,亦可以通过Seyferth-Gilbert同素化制得。
乙炔制作用煤或石油作原料,是生产乙炔的两种主要途径。随着天然气化学工业的发展,天然气即将成为乙炔的主要来源。
电弧法
甲烷在1500℃电弧中经极短时间(0.1~0.01s)加热,裂解成乙炔,即:
2CH4→C2H2+3H2ΔH=397.4KJ/mol
由于乙炔在高温很快分解成碳,故反应气须用水很快地冷却,乙炔产率约15%,改用气流冷却反应气,可提高乙炔产率达25%~30%。裂解气中还含有乙烯、氢和碳尘。这个方法的总特点是原料非常便宜,在天然气丰富的地区采用这个方法是比较经济的。石脑油也可用此方法生产乙炔。
物质应用
加成反应
自由基
和氢加成
乙炔或其一元取代物可与带有下列“活泼氢”的有机物,如—OH,—SH,—NH2,=NH,—CONH2或—COOH发生加成反应,生成含有双键的产物。例如乙醇在碱催化下于150~180℃,0.1~1.5MPa下与乙炔反应,生成乙烯基乙醚。
根据原料的不同,反应条件(即温度、压力i、催化剂等)也可以不同。这类反应的反应机理是烷氧负离子与三键进行亲核加成,产生一个碳负离子中间体,碳负离子中间体从醇分子中得到质子,得产物。
乙烯基乙醚聚合后的聚乙烯基乙醚,常用作黏合剂。
氧化
炔烃经臭氧或高锰酸钾氧化,可发生碳碳三键的断裂,生成两个羧酸。
注意事项
1、乙炔与烷烃不同,炔烃不稳定且非常活跃,乙炔燃烧发出大量的热,乙炔焰常被用来焊接。
2、炔化物干燥后,经撞击而发生强烈爆炸,生成金属和碳。故在反应完了时,应加入稀硝酸使之分解。
3、氰负离子和银可形成极稳定的络合物,再去炔化银中加入氰化钠水溶液可得回炔烃。
4、乙炔不稳定、非常活跃。乙炔储存要避免受热。
5、乙炔禁配强氧化剂、强酸、卤素。
6、乙炔与空气混合,能形成爆炸性混合物,遇明火、高热能引起燃烧、爆炸。
与氧化剂接触猛烈反应。
与氟、氯等接触会发生剧烈的化学反应。
能与铜、银、汞等的化合物生成爆炸性物质。