配位数(阿尔弗雷德·维尔纳提出的概念)

VLoG
次浏览
更新时间:2023-05-23
配位数
本词条是多义词,共2个义项
阿尔弗雷德·维尔纳提出的概念
基本信息
| 中文名 | 配位数 |
| 外文名 | coordination number |
| 大小 | 周期表中的周次 |
| 电荷 | 中心原子的电荷高,配位数就大 |
| 特征 | 中心离子 |
正文
O)
】和【ReH
】中配位数为9;在【Mo(CN)
】和【TaF
】中为8;在【ZrF
】和【NbF
】中为7;在【Ti(H
O)
】、【Co(NH
)
】中为6;在【CdCl
】和Fe(CO)
中为 5;在【BeCl
】、【Zn(CN)
中为4;在【HgI
】中为3;在【Ag(NH
)
】和【Au(CN)
】中为2。配位数为10或更高(11或12)的只在镧系和锕系配合物中偶尔发现,是极少见的。影响配位数的因素如下:
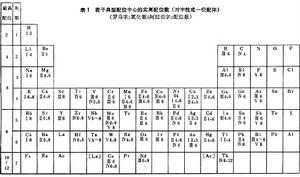
中心原子的大小中心原子的最高配位数决定于它在周期表中的周次。在周期表内,第1周期元素的最高配位数为2,第2周期元素的最高配位数为4,第3周期为6,以下为8、10。最高配位数是指在配合物中,中心原子周围的最高配位原子数,实际上一般可低于最高数(表1)。由表可见,在实际中第1周期元素原子的配位数为2,第2周期不超过4。除个别例外,第3、4周期不超过6,第5、6周期为8。最常见的配位数为4和6,其次为2、5、8。配位数为奇数的通常不如偶数的普遍。
配位数
】、【CdCl
】和【InCl
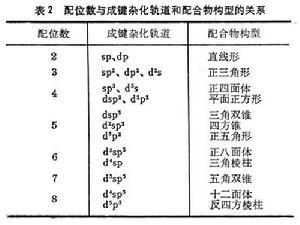
中心原子的成键轨道性质和电子构型从价键理论的观点来说,中心原子成键轨道的性质决定配位数,而中心原子的电子构型对参与成键的杂化轨道的形成很重要,例如,Zn和Cu离子的5个3d轨道是全满的,适合成键的是一个4s和3个4p轨道,经sp杂化形成4个成键轨道,指向正四面体的四个角。因此,Zn和Cu与CN生成配位数为4的配离子【Zn(CN)
】和【Cu(CN)
】,并且是正四面体构型(表2)。
配位数
】,而与F则生成配位数为 6的【FeF
】。这是因为 Fe从每个体积较大而较易极化的Cl接受的电荷要大于体积较小而较难极化的F。
配合物的中心原子与配体间键合的性质,对决定配位数也很重要。在含F的配合物中,中心原子与电负性很高的F间的键合主要是离子键。如在B、Fe和Zr与F的配合物中,随着中心原子半径的增加,配位数分别为4、6和7,主要受中心原子与配体的半径比的限制(表3)。很多配合物的中心原子与配体(例如CN、NO娱、SCN、Br、I、NH
和CO等)间主要形成共价键,它们的配位数决定于中心原子成键轨道的性质。
O和NH
等具有小的相互排斥力的弱场配体,生成配位数为 6的【Ni(H
O)
】和【Ni(NH
)
】等八面体配离子;与Br和I等具有大的相互排斥力的弱场配体则趋向于生成配位数为4的【NiBr
】和【NiI
】等正四面体配离子;与CN等强场配体则生成配位数为4的【Ni(CN)