锆(原子序数为40的过渡金属元素)

VLoG
次浏览
更新时间:2023-05-20
锆
原子序数为40的过渡金属元素

锆(Zirconium)是第40号元素,元素符号为Zr,在元素周期表中位于d区,属第五周期IVB族,为过渡金属,核外电子排布式为[Kr]4d²5s²。锆有两种结构,分别为六方晶系的α型和立方晶系的β型。锆外观呈银灰色有光泽的金属或蓝灰色无定形粉末,不溶于水,微溶于酸,溶于氢氟酸和王水等,其原子量为91.224,密度为6.506 g/cm³。锆具有很强的可塑性,且耐高温、耐腐蚀、耐辐射和耐酸。锆还可以储氢,且在高温下具有良好的吸气性。锆可与水、酸和碱反应,释放出氢气;可与氧、氢、氮和卤素等非金属单质发生加合反应,生成含锆二元化合物;可在高温条件下吸收一氧化碳和二氧化碳,还可与四溴化锆等物质反应。锆最主要的应用是制成合金,应用于原子能工业、电子工业、医疗器械制造及建筑材料制造等领域。此外,锆金属可用于制造化工设备、钢铁冶金,锆粉可用于生产烟花和武器。锆还可作化工原料生产氧化锆等含锆化合物。锆粉极易自燃,在受热、遇明火或接触氧化剂时会引起燃烧爆炸。锆对眼睛、皮肤和黏膜具有刺激性,也可经呼吸道、消化道进入人体,过量时可造成锆中毒。
基本信息
中文名
锆
英文名
Zirconium
拼音
gào
发现者
马丁·亨瑞奇·克勒普鲁斯(Martin Heinrich Klaproth)
元素符号
Zr
原子序数
40
元素类别
过渡金属
族
IVB(第四副族)
周期
5
区
d
电子排布
[Kr]4d²5s²
CAS编号
7440-67-7
摩尔质量
91.224 g/mol
物理性质
外观
银灰色有光泽的金属或蓝灰色无定形粉末
密度
6.506 g/cm³
熔点
1852 ℃
沸点
4377 ℃
水溶性
不溶于水,微溶于酸,溶于氢氟酸和王水
比热容
278 J/(kg·K)
蒸气压
1.05×10⁻¹⁰ Pa(1126.85 ℃), 6.17×10⁻⁸ Pa(1326.85 ℃)
原子性质
氧化态
ZrO₂
电负性
1.33(鲍林标度)
原子半径
1.60 Å
历史
发现
1789年,德国化学家马丁·亨瑞奇·克勒普鲁斯(Martin Heinrich Klaproth)在斯里兰卡开采的锆石中发现了一种未知元素的氧化物,即氧化锆,克勒普鲁斯便将这种新元素命名为“Zirconium”,取自阿拉伯语“Zargun”,意为金色。
1824年,瑞典化学家乔恩·贝采利乌斯(Jons Berzelius)通过加热六氟锆酸钾和钾金属而首次制备出了不纯的黑色粉末状锆。1914年,德国化学家莱利(D. Lely)和汗布格尔(Hamburger)用高纯钠还原四氯化锆并提纯制备出了高纯的韧性金属锆。1925年,荷兰化学家安东·爱德华·范阿克尔(Anton Eduard van Arkel)和贾恩·昂德里克·德布尔(Jan Hendrik de Boer)通过分解碘化锆制备出了极纯的锆。
工业发展
1944年,美国矿务局(U.S. Brreau of Mine)在克劳尔(W. J. Kroll)的指导下成功研发出了锆的大规模生产方法。该法被称为Kroll法并沿用至今。1947年,费舍尔(W. Fischer)等人首次研究出由溶剂萃取法分离锆和铪。1949年,美国橡树岭Y-12工厂首次在工业中成功分离锆和铪。1950年,美国原子能委员会(U.S.A.E.C.)决定在核潜艇上使用锆合金作为核反应堆的包套和结构材料,之后又逐渐应用于核发电站中。从20世纪70年代起,世界各国竞相发展核电,到80年代末,西方国家海绵锆年产能力达7000-8000 t。中国于1956年开始研制原子能级海绵锆,1964年第一个试验厂试车,1967年开始进行工业生产,到20世纪70年代初已建成较为完整的锆冶炼和加工的研究和生产体系。
分布情况
锆虽被称为稀有金属,但其在地壳中的含量却十分丰富,丰度为165 mg/kg。锆在岩石、土壤、海洋沉积物和海水中的平均浓度分别为170 ppm、300 ppm、132 ppm和4 ppb。含锆的主要矿物有锆石,成分为ZrSiO₄,其分布最为广泛;铪锆石,成分为(Zr,Hf)SiO₄;异性石,成分为(Na,Ca)₅ZrSi₆O₁₇(OH·Cl)₂;斜锆石,成分为ZrO₂。锆矿床主要有锆石砂矿床,为冲积砂矿和海滨砂矿,是由锆石与独居石、钛石、钛铁矿及金红石等组成综合性矿床,以及由岩浆形成的含斜锆石的碳酸岩矿床和含异性石的碱性岩矿床等。其中具有工业开采价值的矿物为锆石和斜锆石。锆在自然界中常与铪共生,没有单独存在的形式。世界探明锆石储量4900万吨,储量基础5800万吨,主要分布在澳大利亚、南非、美国、印度。
锆还广泛存在于生物体中。锆在植物中可存在于藻类、地衣、苔藓、蕨类和松柏类中。其在生物圈中具有迁移和富集效应,能紧密结合在有机物碎片、浮游生物表面和陆生苔藓植物中。锆还广泛分布在人和动物体内,其中以软组织分布最多。成年人体中锆的含量约为420 mg。此外,大多数食品中也含有锆,新鲜肉中锆的平均含量约为1-3 mg/kg,水果和海产品则相对较少,人日均累积摄入锆含量约为3.5 mg。
晶体结构
锆有两种结构,分别为α型和β型,在相变温度860-870 ℃以下时为α型,以上时为β型。α型的锆晶体结构为六方晶系,属P63/mmc空间群。在α型锆晶体中,锆原子与十二个等效的锆原子成键,其中六根Zr-Zr键较短,键长为3.19 Å;另外六根Zr-Zr键较长,键长为3.24 Å。其晶胞参数为a=b=3.24 Å,c=5.17 Å;α=β=90°,γ=120°。晶体结构透视图如下:
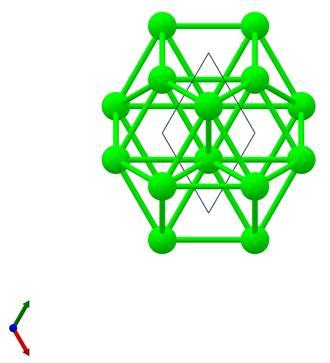
α型锆晶体结构透视图
β型的锆晶体结构为立方晶系,属Fm3 m空间群。在β型锆晶体中,锆原子也与十二个等效的锆原子成键,Zr-Zr键长度均为3.20 Å。其晶胞参数为a=b=c=4.53 Å,α=β=γ=90°。晶体结构透视图如下:
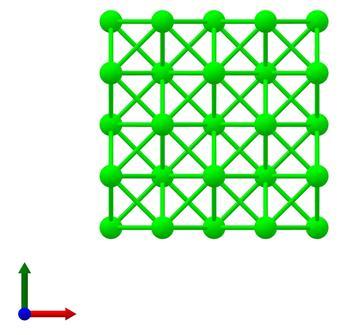
β型锆晶体结构透视图
理化性质
同位素
锆有5种天然稳定存在的同位素,为⁹⁰Zr、⁹¹Zr、⁹²Zr、⁹⁴Zr和⁹⁶Zr,其丰度分别51.45%、11.22%、17.15%、17.38%和2.80%。此外还有21种质量范围为80-89、93、95和97-105的人工放射性同位素。其中寿命最长的放射性同位素为⁹³Zr,半衰期为1.5×10⁶ 年;寿命最短的放射性同位素为¹⁰⁵Zr,半衰期为1 秒。
物理性质
锆外观呈银灰色有光泽的金属或蓝灰色无定形粉末,不溶于水。锆具有很强的可塑性,且耐高温、耐腐蚀和耐酸。锆在有机酸中耐腐蚀,但在氢氟酸、浓硫酸、浓磷酸、王水、溴水、氢溴酸、氟硅酸、次氯酸钙、氟硼酸中不耐腐蚀。锆的热中子俘获截面较小,为0.18 b,所以具有耐辐射性。锆还可以储氢,且在高温下具有良好的吸气性,能强烈地吸收氧气、氢气和氮气等气体。锆的原子量为91.224,密度为6.506 g/cm³,熔点为1852 ℃,沸点为4377 ℃,电负性为1.33(鲍林标度),第一电离能为640.074 KJ/mol,比热容为278 J/(kg·K),蒸气压为1.05×10⁻¹⁰ Pa(1126.85 ℃),电阻率为38.8 microhm-cm(0 ℃),磁化率为1.55×10⁻⁶(cgs),杨氏模量为11.35×10⁶ psi(退火),剪切模量为5.42×10⁶ psi,泊松比为0.33。
化学性质
锆可与水、酸和碱反应,释放出氢气;可与氧、氢、氮和卤素等非金属单质发生加合反应,生成含锆二元化合物;可在高温条件下吸收一氧化碳和二氧化碳,还可与四溴化锆等物质反应。锆在水溶液中以+4价形式存在,而在无水锆化合物中可以+1、+2、+3和+4价形式存在。最常见的锆化合物为锆英石(ZrSiO₄)和氧化锆(ZrO₂),其余还包括氢化锆(ZrH₂)、碳化锆(ZrC)、氮化锆(ZrN)、三氯化锆(ZrCl₃)、四氯化锆(ZrCl₄)、氯氧化锆(ZrOCl₂·8H₂O)、氟化锆(ZrF₄)、锆氟酸钾(K₂ZrF₄)、氟氧化锆(ZrOF₂)、硫酸锆[Zr(SO₄)₂]、碱色碳酸锆[Zr(OH)₂CO₃]、碱色硫酸锆[Zr(OH)₂SO₄]、磷酸锆(ZrO₂·nP₂O₅)、碳锆酸酰胺[(NH₄)₂ZrO(CO₃)₂]、碳锆酸酰钾[K₂ZrO(CO₃)₂]、偏高酸钙(CaZrO₃)和锆酸盐(BaZrO₃、MgZrO₃、PbZrO₃)等。
与水反应
锆是一种强烈的氢化物形成元素,易与水反应,随温度升高反应加速并释放出大量氢气,反应方程式如下:

与酸、碱反应


与非金属单质反应
与氧气反应
锆可与氧气反应,生成氧化锆,反应方程式如下。粉末形式的锆易自燃形成氧化锆,根据粒度大小不同其着火点在80-285 ℃之间;固体金属锆则在常温下是稳定的,加热至200 ℃时可与氧气缓慢反应,在高温下迅速反应。氧化锆生成后可在锆表面形成一层坚固的氧化膜,使得锆或锆合金具有优良的抗腐蚀能力。

与氢气反应
锆可在300-1000 ℃的温度下与氢气反应,生成性脆的氢化锆,反应方程式如下。在锆合金中此反应可引起氢脆效应,降低合金的延展性。

与卤素反应
锆可在200-400 ℃的温度下与卤素单质反应,生成四卤化锆,反应方程式如下:

与氮气反应
锆在400 ℃时可与氮气反应,800 ℃以上时反应迅速,生成难熔化合物氮化锆,反应方程式如下。此外,锆在高温下还可与硫、磷和碳等非金属加合生成二元化合物。

与二氧化碳、一氧化碳反应
锆可在1000 ℃以上时与二氧化碳反应或在800 ℃以上时与一氧化碳反应,生成氧化锆和难熔化合物碳化锆,反应方程式如下:


与四溴化锆反应
锆可与过量的四溴化锆在真空下于300 ℃反应,加热8小时后将四溴化锆转变为三溴化锆,反应方程式如下:

制备方法
矿物提取法
锆金属通常经由开采矿石提取而得,如锆石、斜锆石等。矿石经开采、粉碎后进行初步分离,分离出的矿石与碳混合并高温共热,生成碳化锆,将碳化锆在氯气中高温加热,转化为四氯化锆,再经萃取将铪与锆分离。最后利用kroll法,即在氦气气氛中将四氯化锆蒸气用熔融镁还原即可得金属锆和氯化镁,反应方程式如下。减压蒸馏除去氯化镁后即得金属锆成品。

锆粉的制备
锆粉可由氢化-脱氢法、还原法和电解法制得。由于锆粉是一种易燃易爆的危险品,所以制备后需进行钝化处理。
氢化-脱氢法
锆粉可以金属锆为原料,采用氢化﹣脱氢法制得。先将金属锆在高温下与氢气加合形成氢化锆,氢化锆经粉碎、分级得氢化锆粉末,将氢化锆粉末在高温下真空脱氢即制得锆粉。反应原理如下:


还原法

电解法

检测方法
电感耦合等离子体质谱法
偶氮胂III光度法
锆含量可由偶氮胂III光度法进行检测。试样由氢氧化钠和水加热溶解后经硝酸酸化,由于硝酸中的氧化氮对偶氮胂III试剂有破坏作用,所以需加入少量尿素溶液将其分解。最后加入偶氮胂III溶液,偶氮胂III可与锆生成蓝色络合物,于665 nm处测定溶液吸光度,由标准曲线可得锆含量。
二甲酚橙光度法
锆含量可由二甲酚橙光度法进行检测。试样经盐酸溶解后,在加热条件下加入过氧化氢和水,煮沸冷却后再加入抗坏血酸溶液和二甲酚橙溶液,二甲酚橙溶液可与锆在酸性条件下生成红色络合物,于540 nm处测定溶液吸光度,由标准曲线可得锆含量。
其他方法
锆还可由火焰原子吸收法、电感耦合等离子发射光谱法和中子活化法等进行检测。
应用领域
锆的应用
纯锆金属具有优良的耐酸、碱性等,因此在化工、农药、化肥和染料等设备中用于反应器、泵、热交换器、阀门、搅拌器、喷嘴、热电偶套管、导管和容器衬里等的制造。锆丝可用作空气等离子切割机的电极头。锆屑可作炼钢添加剂,用于脱氧、脱氮;也可作晶粒细化剂,用于铝合金的生产。锆粉可用于粉末冶金、生产焰火发光剂,且锆粉摩擦时能发射出足以点燃烃类蒸气的高温火花束,所以可在军事中用于制造子弹和炮弹的信管以及烈性炸药、穿甲燃烧弹药和燃烧集束炸弹等武器。
锆化合物的应用
应用最广泛的含锆化合物为氧化锆,可用作耐火材料、研磨材料、电子材料、玻璃添加剂、宝石原料、敏感器材料和精密陶瓷材料等。此外,锆硅酸盐和锆氯氧化物可用于生产止汗剂和化妆品;氰亚铁酸锆和柠檬酸锆可用于清除人和动物体中的放射性锶;硫酸锆可用作蛋白质沉淀剂和皮革鞣剂;氟酸锆可作陶化剂以提高金属涂层的耐腐蚀性能。锆化合物还可用于纯化受污染的水,清除其中的铅和砷等重金属元素。
锆合金的应用
锆可与其他金属或非金属制成合金,在原子能工业、电子工业、医疗器械制造及建筑材料制造等领域拥有广泛应用。
原子能工业
锆合金可用于原子能工业。由于锆具有熔点高、密度适中、强度高、可塑性强和中子俘获截面较小等优点,所以其合金可用作核反应堆、核燃料、核潜艇和铀棒的结构材料,常用的锆合金有Zr-2、Zr-4、Zr-1Nb和Zr-2.5Nb等。美国田纳西州橡树岭国家实验室中的核反应堆即由锆合金建造而成,用于进行铀的裂变反应。
电子工业
锆合金可用于电子工业。由于锆具有吸气性,可添加其他元素形成具有高吸收活性气体特性的合金用作电子管工业中的吸气剂。如锆石墨吸气剂可用于行波管、X光管和触发管等中,锆钒铁合金吸气剂可用于不锈钢真空保温杯、太阳能真空热水器和石油高效隔热管中。由于锆合金具有相当好的电子放射性能,所以还可在电子工业中用于生产回转加速器及其他特种电子仪器等。
医疗器械制造
锆合金可用于医疗器械的制造。由于锆合金具有良好的力学性能、耐腐蚀性和生物相容性以及较低的弹性模量等优点,所以可用于医疗器械的制造,如用于义肢、骨和肌肉的植入材料及可佩戴式人工肾脏的制造,还可用于血液过滤、血液透析和腹膜透析等检验中。
其他领域
由于锆合金具有高耐热性,所以可用于航天器零部件如火箭喷嘴、喷气发动机叶片等的制造,以防止航天器返回地球经大气层时发热严重。在其他建筑领域中,锆合金还广泛应用于轴承、板材、管材、锻件、棒材、焊丝、磨料、陶瓷色料和耐火材料等的制造。
安全事宜
毒理学数据
LD₅₀ 大鼠口服:3.5-10 g/kg
职业接触极限
5 mg/cm³(TWA), 10 mg/cm³(STEL)
健康危害
锆对眼睛、皮肤和黏膜具有刺激性,也可经呼吸道、消化道进入人体,过量时可造成锆中毒。锆能抑制ATP酶、碱性磷酸酶和过氧化物酶等的活性,其沉积在骨骼中可能会导致维生素D抵抗的透析性软骨病的产生。锆还能引起急性和暴发性肺泡炎样超敏反应,症状表现为干咳和呼吸困难。锆具有抗原特性,可引起肺肉瘤样肉芽肿病等。
其他危害
锆粉极易自燃,在受热、遇明火或接触氧化剂时会引起燃烧爆炸,锆粉也能在二氧化碳及氮气中燃烧。
应对措施
急救
皮肤接触 | 脱去被污染的衣物,用流动清水冲洗并及时就医 |
眼睛接触 | 提起眼睑,用流动清水或生理盐水冲洗并及时就医 |
吸入 | 迅速脱离现场至空气新鲜处,保持呼吸道通畅并及时就医。若呼吸困难应进行输氧;若呼吸停止应立即进行人工呼吸 |
摄入 | 饮足量温水,催吐并及时就医 |
消防
若发生锆起火时,不得使用普通灭火器或水进行灭火,应使用干砂、粉状石墨或特殊金属粉末等进行灭火。
防护措施
呼吸系统防护 | 空气中粉尘浓度超标时,建议戴自吸过滤式防尘口罩 |
眼睛防护 | 空气中粉尘浓度超标时,建议戴化学安全防护眼镜 |
身体防护 | 穿一般作业防护服 |
手防护 | 戴防化学品手套 |
其他防护 | 操作场所应安装良好的通风设备;注意个人卫生习惯,严禁在工作场所吸烟、进食和饮水 |
储存与贮运
锆应严格按照放射性物质的运输规则进行运输,且货物包装上要有明显的放射性标志,运输中使用过的车皮等要进行用后清洗,装卸作业要穿戴防护用品,同时要防止撒漏和粉尘飞扬。锆应储存在非易燃容器和封闭区域中,不得与食品、易燃易爆物品等混放。锆粉须在干燥氩气中存放,可用玻璃瓶或金属桶盛装并外加箱皮保护,不得与氧化剂混放。


