p区元素(元素周期表中IIIA族元素~0族元素)

VLoG
次浏览
更新时间:2023-05-20
p区元素
元素周期表中IIIA族元素~0族元素
基本信息
| 中文名 | p区元素 |
| 外文名 | elements of area p |
| 学科 | |
| 包括 | IIIA族元素~0族元素 |
p区元素概述
原子半径
p区元素包括了除氢以外的所有非金属元素和部分金属元素。p区元素的原子半径在同一族中,自上而下逐渐增大,获得电子的能力、元素的非金属性逐渐减弱,金属性逐渐增强。这些变化规律在第ⅢA~ⅤA族中表现得很突出。除第ⅦA和0族外,p区元素都由明显的非金属过渡到金属元素。第二周期中的元素与同族其它元素相比,化学性质有较大的差别。
电子构型
p区元素的价电子构型为ns np ,它们大多都有多种氧化态。ⅢA~ⅤA族元素自上而下,低氧化态化合物的稳定性逐渐增强,高氧化态化合物的稳定性则逐渐减弱。
例如,ⅣA族中的Si(Ⅳ)的化合物很稳定,Si(Ⅱ)的化合物则不稳定;Ge(Ⅳ)的化合物较Ge(Ⅱ)化合物稍稳定些;Pb(Ⅳ)的化合物很不稳定,而Pb(Ⅱ)的化合物则较稳定,Pb(Ⅳ)容易得到电子变为Pb(Ⅱ),表现出强氧化性。这种同一族元素自上而下低氧化态化合物较高氧化态化合物越来越稳定的现象叫做惰性电子对效应。
一般认为,随着原子序数的增加,外层ns轨道中的这对电子越来越不容易参与成键,显示出一定的惰性。因此高氧化态化合物易获得2个电子而形成ns 电子结构。
第二周期元素的反常性
按照一般的规律,同一族中元素单键键能自上而下依次递减,但第二周期元素则反常。例如,氮、氧、氟的单键键能分别小于第三周期元素磷、硫、氯的单键键能。
造成这一反常现象的原因是:N、O、F原子半径小,两原子成键时键长较短,原子中未参与成键的电子之间有明显的排斥作用,从而削弱了共价单键的强度。
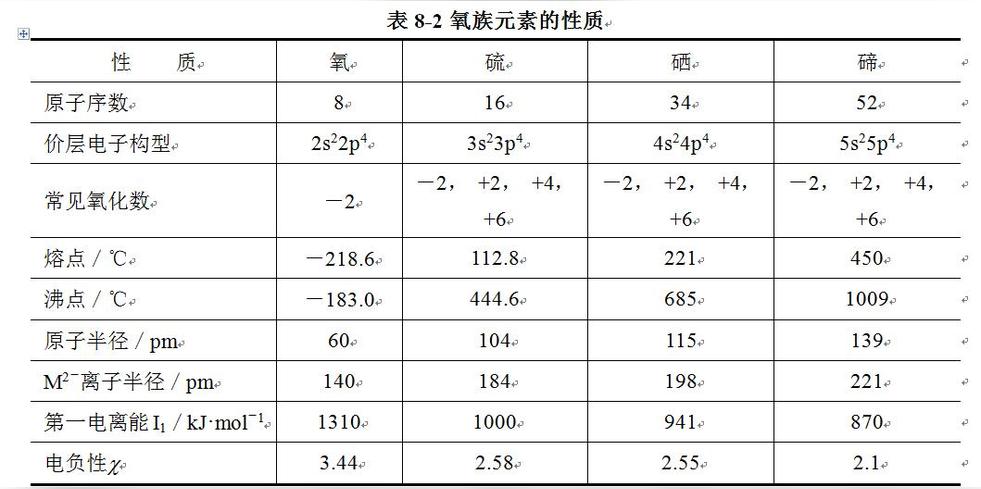
氟、氯、溴、碘及其化合物
周期表中的ⅦA族元素,包括氟(Fluorine)、氯(Chlorine)、溴(Bromine)、碘(Iodine)和砹(Astatine)等五种元素,通称为卤族元素(halogens group)。因它们都能直接和金属化合生成盐类,例如NaCl,故得名,希腊原文意为“成盐元素”。砹是人工合成的放射性元素,不稳定,对它的性质研究尚少,但确知砹和碘性质相近。
p区元素
卤素在化合物中常见的氧化数为-1。除氟以外,卤素与电负性比它强的元素(主要是氧)化合时,还可以形成正的氧化数,如+1、+3、+5和+7。其氧化数之间的差值之所以为2,是因为它们的原子中有些价电子已经成对,若要形成化学键,一定要先将成对电子拆开,这可使氧化数增加2。
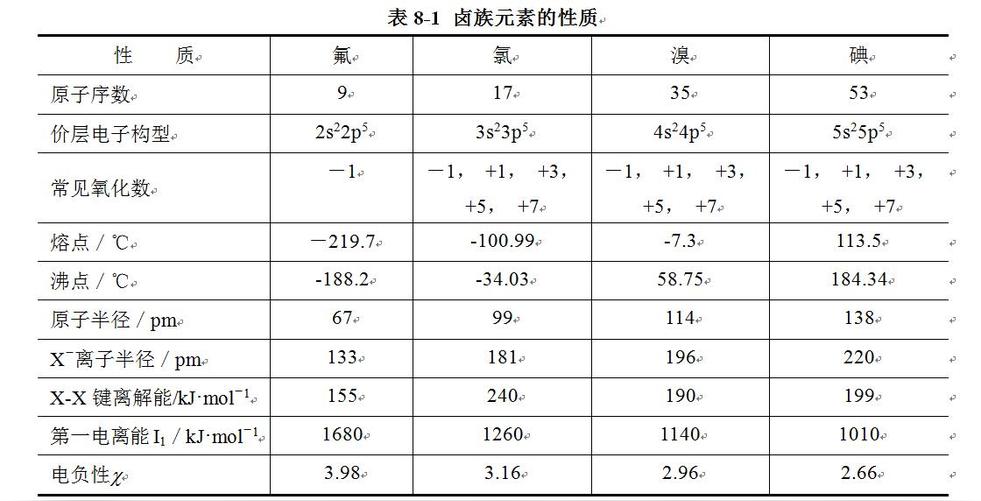
氧、硫及其化合物
周期表中的ⅥA族元素,包括氧(Oxygen)、硫(Sulfur)、硒(Selenium)、碲(Tellurium)、钋(Polonium)五个元素,通称为氧族元素。其中氧是地壳中含量最多的元素,丰度以质量计高达46.6%。硒、碲是稀有元素。钋是放射性元素。
氧族元素的一些主要性质列于下表。
氧族元素原子的价层电子构型为nsnp,有获得2个电子达到稀有气体稳定结构的趋势。
氧族元素原子和其他元素化合时,如果电负性相差很大,则可以有电子的转移。例如,氧可以和大多数金属形成二元离子化合物,硫、硒、碲只能形成少数离子型的化合物。
氧族元素和高价态的金属或非金属化合时,所生成的化合物主要为共价化合物。
氧族元素与电负性比它们大的元素化合时,可呈现+2、+4、+6氧化数。
氧和硫的性质相似,都活泼。它们对应化合物的性质也有很多相似之处。
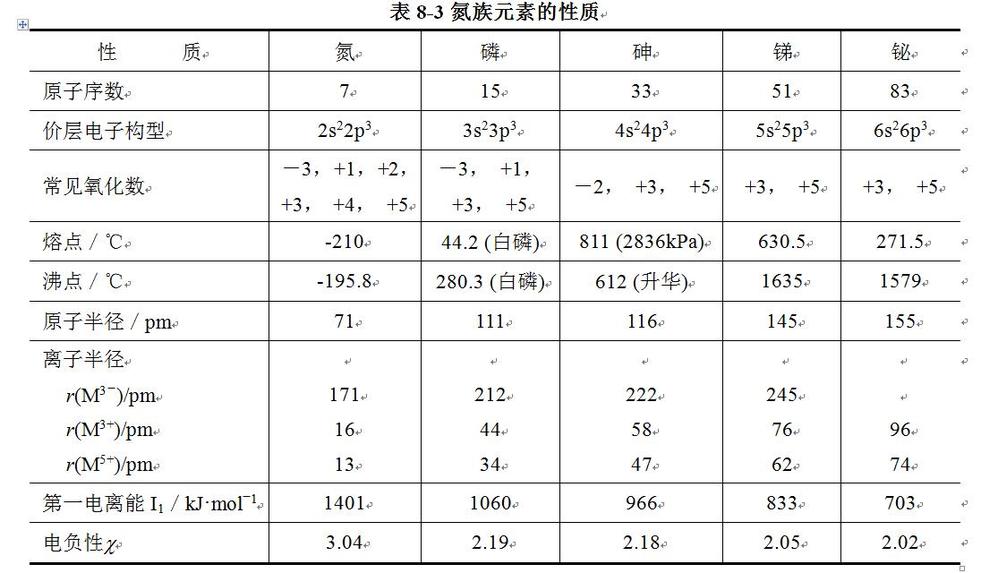
氮、磷、砷、锑、铋及其化合物
周期表中的ⅤA族元素,包括氮(Nitrogen)、磷(Phosphorus)、砷(Arsenic)、锑(Antimony)、铋(Bismuth)五种元素,通称为氮族元素。氮以游离状态存在于空气中。砷、锑、铋是亲硫元素,它们在自然界中主要以硫化物矿的形式存在。
氮族元素的一些主要性质列于下表。
p区元素
氮族元素的价电子层结构为nsnp,与卤素和氧族元素相比,形成正氧化数化合物的趋势较明显。它们和电负性较大的元素结合时,氧化数主要为+3和+5。在氮族元素中,按As-Sb-Bi的顺序,随着核电荷的增加ns价电子的稳定性增加,即依As-Sb-Bi的顺序,元素表现为+3的特性逐渐增强,常称此现象为“惰性电子对效应”。故Bi(Ⅴ)具有很强的氧化性。
碳、硅、锡、铅及其化合物
碳元素在地壳中约占0.03%,但它却是地球上分布最广、化合物最多的元素。碳存在二种同素异形体,金刚石、石墨,由于它们的晶体结构不同,所以性质上迥然不同。1985年,碳的球形多面体原子簇C以及C、C、C、C、C、C、C、……C、C等的相继问世,使碳又多了一类同素异形体——富勒烯(Fullerenes)。
碳族元素由上而下从典型的非金属元素碳、硅过渡到典型的金属元素锡和铅。
碳族元素的价层电子构型为nsnp,能够形成氧化数为+2、+4的化合物。碳、硅主要形成氧化数为+4的化合物;碳有时还能形成氧化数为-4的化合物。锡氧化数为+2的化合物具有强还原性。而由于“惰性电子对效应”, Pb氧化数为+4的化合物有强氧化性,易被还原为Pb,所以铅的化合物以+2氧化数为主。