酸式盐(可电离出氢离子的盐化合物)

VLoG
次浏览
更新时间:2023-05-23
酸式盐
可电离出氢离子的盐化合物

酸碱性判断
① 水溶液呈酸性的酸式盐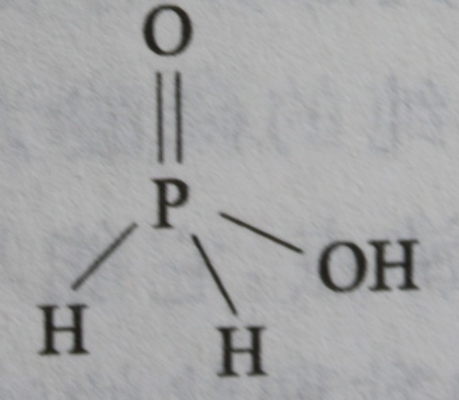 强碱强酸的酸式盐:如
强碱强酸的酸式盐:如  ,在其水溶液中发生完全电离,因此溶液呈酸性;
,在其水溶液中发生完全电离,因此溶液呈酸性;

次磷酸结构式

②水溶液呈碱性的酸式盐:
一般为强碱弱酸的酸式盐,如: --盐,
--盐, --盐,因“电离”趋势小于“水解”趋势,所以溶液呈碱性。
--盐,因“电离”趋势小于“水解”趋势,所以溶液呈碱性。


性质
1、水中的溶解性。一般来说,在相同温度下,不溶性正盐对应的酸式盐的溶解度比正盐的大,如 难溶于水,
难溶于水, 易溶于水;磷酸的钙盐溶解性由大到小为:
易溶于水;磷酸的钙盐溶解性由大到小为: >
> >
> 。可溶性正盐对应的酸式盐溶解度比其正盐的小,如
。可溶性正盐对应的酸式盐溶解度比其正盐的小,如 的溶解性大于
的溶解性大于 ,
, 的溶解性大于
的溶解性大于 。正因为如此,向饱和的碳酸钠溶液中通入过量的二氧化碳有沉淀生成,其反应的方程式为:
。正因为如此,向饱和的碳酸钠溶液中通入过量的二氧化碳有沉淀生成,其反应的方程式为:



















3、与酸的反应。强酸的酸式盐与酸不发生复分解反应。尽管是盐,但可做强酸用,其水溶液具有酸的通性,如 可与活泼性在氢之前的金属反应,生成氢气;可与
可与活泼性在氢之前的金属反应,生成氢气;可与 反应,生成
反应,生成 。弱酸的酸式盐与对应的酸不反应(
。弱酸的酸式盐与对应的酸不反应( 例外),可与酸性比其强的酸反应,生成新酸和新盐,(强酸制弱酸原理)如
例外),可与酸性比其强的酸反应,生成新酸和新盐,(强酸制弱酸原理)如 可与HCl、
可与HCl、 、
、 在水溶液中反应。
在水溶液中反应。







常见酸式酸根与酸反应的离子方程式有:






4、酸式盐电离和水解。强酸的酸式盐只能电离,不能发生水解,如 的水溶液一定显酸性;弱酸的酸式盐既可电离,也可水解,其水溶液的酸碱性将由电离和水解以及阳离子等方面决定。中学不研究弱酸弱碱盐溶液的酸碱性,因此,对于强碱弱酸对应的酸式盐溶液的酸碱性就由电离和水解两个方面来决定。当电离大于水解的趋势,其水溶液显酸性,如
的水溶液一定显酸性;弱酸的酸式盐既可电离,也可水解,其水溶液的酸碱性将由电离和水解以及阳离子等方面决定。中学不研究弱酸弱碱盐溶液的酸碱性,因此,对于强碱弱酸对应的酸式盐溶液的酸碱性就由电离和水解两个方面来决定。当电离大于水解的趋势,其水溶液显酸性,如 、
、 ;当水解大于电离的趋势,其水溶液显碱性,如
;当水解大于电离的趋势,其水溶液显碱性,如 、
、 、
、 。当然,电离和水解的趋势哪个大最根本的是要由实验来判断。但是对中学化学中常见的几种,我们要记住。
。当然,电离和水解的趋势哪个大最根本的是要由实验来判断。但是对中学化学中常见的几种,我们要记住。






5、对热的稳定性。一般说来,热稳定性大小顺序为:可溶性正盐>不可溶正盐>酸式盐>多元酸(对同一类酸而言)。如:



































