氧化钾(一种金属氧化物)

VLoG
次浏览
更新时间:2023-05-23
氧化钾
一种金属氧化物
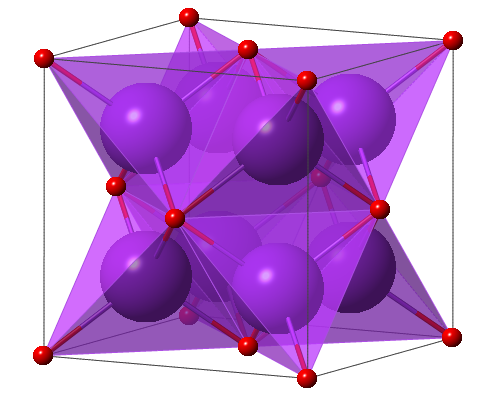
氧化钾(英文:potassium oxide)是一种碱金属氧化物,有着立方反萤石的晶体结构,化学符号是K₂O,摩尔质量是94.196 g/mol,密度是2.3 g/cm³,易潮解,在350 ℃时易分解,易溶于水并与水发生化合反应生成氢氧化钾。氧化钾可以与水发生反应生成氢氧化钾,因此氧化钾包装应注意密封性且存储于干燥阴凉通风的库房。氧化钾具有较强的毒性,接触皮肤会造成严重皮肤灼伤,且对眼睛有更强的刺激性,会造成严重眼损伤,泄漏时还会对环境造成一定的污染。
氧化钾主要通过金属钾氧化制得。它在工业、农业等领域有不同的应用,最常见的用途是作为制备许多含钾化合物的重要原料,还可以用来制作肥料用于农业生产中。
环境分布
氧化钾主要存在于矿物中,富钾矿物可分为水溶性钾矿资源和非水溶性钾矿资源。其中水溶性钾盐资源主要有钾石盐、光卤石、硫酸钾、混合钾盐和液态钾盐5种类型,而非水溶性钾矿资源主要有富钾正长岩、富钾板岩、富钾页岩、富钾火山岩等。世界上钾盐主要来源于水溶性钾矿资源,但水溶性钾矿资源的分布不均衡,大多数分布于加拿大、俄罗斯和白俄罗斯等少数国家中。
理化性质
物理性质
化学性质
氧化钾在潮湿空气中易潮解,会与水发生反应生成氢氧化钾。氧化钾也会与气体发生反应,它与不同含量的氧气反应会得到不同产物。除氧气以外,氧化钾可以和二氧化碳反应生成碳酸钾,它还会与氢气发生反应生产氢氧化钾和金属单质钾,与氯气反应生成相应的钾盐。该碱金属氧化物可与酸反应生成相应的盐和水。介绍以下几种反应:
(1)氧化钾与水的反应

(2)氧化钾与气体的反应


(3)氧化钾与氧气反应则生成超氧化钾

(4)氧化钾与非金属氧化物的反应



(5)氧化钾与酸的反应


制备方法
合成法
2.微微加热,通入很小量的干燥纯空气,让金属钾与氧气反应生成氧化钾。尚未反应的氧化钾因反应热熔融,避免过氧化钾的产生。

3.然后同样操作进行数次可得到微粒状的氧化钾。
4.然后在350℃下进行真空蒸馏,除去过量未反应的金属钾,获得高纯度的氧化钾。
高温分解法

过氧化钾在高温下发生分解反应,生成氧化钾和氧气。

废料中氧化钾的提取
将所得废次品含钾物料与水按比例混合,获得对应的混合液。然后对其进行除杂,得到清液。将所得清液浓缩至出现氧化钾晶体后,采用冷却结晶的方法获得氧化钾晶体。最后是提纯、分离。
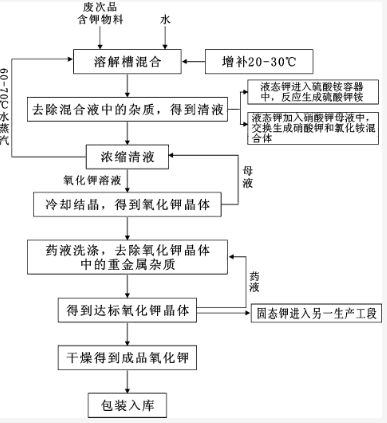
图3-1 提取流程
测定技术
火焰光度法
原理:将所测溶液的发射强度值与标准系列工作溶液的发射强度值进行比对,可计算得到所测溶液的质量分数。
火焰原子吸收光谱法
原理:将所测溶液的吸光度与标准系列工作溶液吸光度进行比对,可计算得到所测溶液的质量分数。
应用领域
农药
氧化钾可用于制作肥料,不仅可以改变土壤的酸度,还可以对被重金属污染的土壤进行一定程度的修复,而且在土壤中添加合理的钾肥可提高植株的抗逆性, 同时也能促进植物体内叶绿体合成。施加合理的钾肥量可以保证植物可以获得充足的营养供应,从而促进黄瓜增产,改善果实品质。而且合理的钾肥量不仅能促进幼苗根系生长, 还有助于植物对氮元素的吸收。
催化剂
氧化钾可作为助催化剂,增加催化剂表面的碱性位点,提高催化剂活性。而且该催化剂在氧化钾的帮助下,具有良好的重复使用效能。
氧化钾也可用作酸性气体吸收剂或干燥剂
工业
氧化钾可作为改性剂提高微晶玻璃的烧结性能,改善微晶玻璃的电学性能,提高其在基板材料领域应用的可能性。
安全事宜
健康危害
氧化钾熔融物与皮肤接触会造成严重皮肤灼伤。氧化钾对眼睛有刺激性,会造成严重眼损伤。稀释水可能具有一定的腐蚀性或者毒性,并会造成环境污染。
相关措施
泄漏区处理措施
首先隔离泄漏区域,处理人员做好防护措施后将泄漏物质转移至相关处理容器中。若是固体泄露,隔离区域在所有方向上至少有25米间距;若是液体泄露,隔离区域在所有方向上至少有50米间距。
急救措施
皮肤接触:立即将被污染的衣物脱下,用大量自来水或肥皂水冲洗至少20分钟。
眼睛接触:用大量水冲洗至少20分钟。
防护措施:带好防护眼镜和防护衣。
灭火方法
避免使用水喷射灭火,该方法可能导致液体飞溅。用水喷雾、干粉、耐酒精泡沫或者二氧化碳灭火剂灭火。
储存运输
根据其性质,氧化钾会与水反应,需密封储存于干燥、阴凉、防潮处。氧化钾还会与酸和某些吸收剂发生反应,因此不可与酸类、某些有机溶剂共同存放。


