白磷(一种磷的单质)

VLoG
次浏览
更新时间:2023-05-19
白磷
一种磷的单质
白磷(英文:Phosphorus white),别名黄磷,是磷的一种同素异形体单质,分子式为P₄。白磷的外观为白色蜡状固体,质软,熔点低,有恶臭。白磷在暗处可以发磷光,在阳光照射下或受热后可以转化为红磷,白磷的燃点34 °C,燃烧生成的产物为P₄O₁₀白色烟雾,因此白磷需要水封保存。白磷有剧毒,对人体的毒性多数是由口服引起的,急性中毒会引发腹痛、呕吐、腹泻等症状。白磷直接落到人体皮肤上会燃烧产生高温,对皮肤造成损伤。白磷在军事上可用于制造发烟剂,还可以用于制造燃烧弹和手榴弹。
基本信息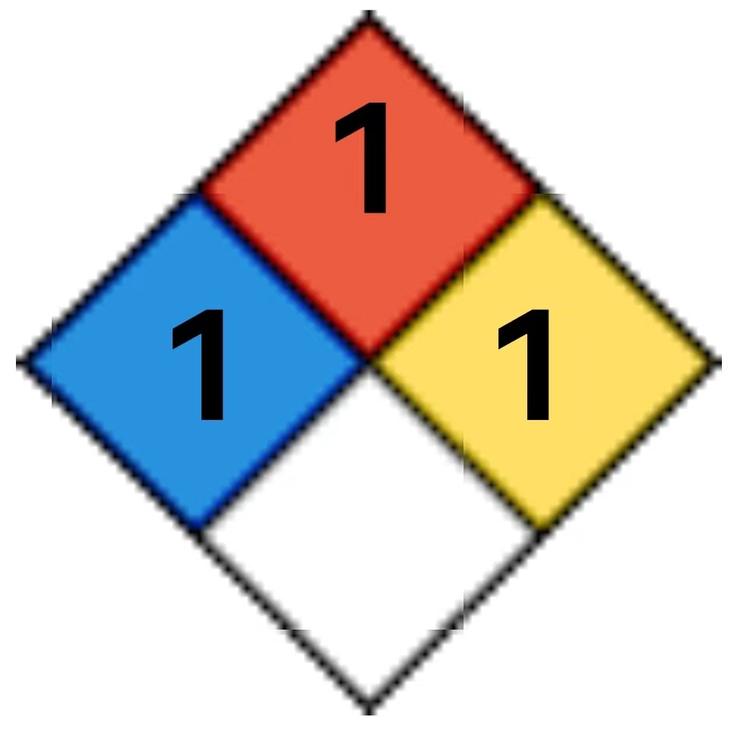
中文名
白磷
英文名
Phosphorus white
别名
黄磷
拼音
bái lín
CAS号
7723-14-0
性质
化学式
P₄
摩尔质量
123.90
外观
无色至黄色蜡状固体
气味
蒜臭味
密度
1.82 g/cm³
熔点
44.1 °C
沸点
280 °C
溶解性
不溶于水,微溶于苯、乙腈、氯仿,溶于二硫化碳
蒸气压
0.181 mm Hg(44.1 °C)
危险性
NFPA 704
示意图

健康危害等级:1(可以引起严重刺激)
可燃性等级:1(需要预热才可以被点燃)
稳定性等级:1(通常条件下稳定,但在加热、加压的条件下变得不稳定)
闪点
30 °C
自燃温度
34 °C
历史
1669年,德国汉堡商人布兰德(Brand H)试图利用砂、木炭、石灰等和尿混合的方法制备黄金,结果却意外得到一种能在暗处发出闪烁亮光的白色软质物体,布兰德将其命名为“冷光”,即我们现在所熟知的白磷。后来,克拉夫特(Krafft D)和波意耳(Boyle R)也几乎同时制造出了磷。
到了18世纪,人们已经知道磷在纯氧中根本不会发光。1974年,范泽(van Zee R J)和可汗(Khan A U )解释了这种发光,即白磷与氧气反应发生的固体磷的表明,形成短寿命的HPO和P₂O₂,这两者都可以发射可见光。
1868年,布赖森(C. Brison)首先提出用高炉熔炼磷矿的方法来生产磷和磷酸,并在英国获得专利。1924年,美国维克托(Victor)化工厂在芝加哥建立了中试的高炉装置,使白磷的日产量达到了2.47吨,后来又在纳许维尔建设了炼磷高炉,使白磷的日产能力达到50吨。
物质结构
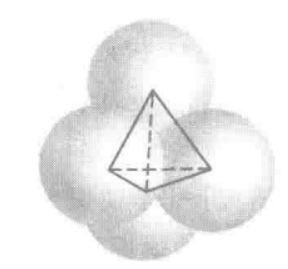
在白磷分子P₄中,白磷单四个P原子呈正四面体的结构分布(见P₄的几何结构),成键方式为每个P原子的三个单电子轨道分别与另外三个P原子的三个单电子轨道弯曲重叠,形成三个弯曲共价键,从而使得每个P原子都可以达到正四面体全满对称的平衡稳定结构(见P₄的拓扑结构)。从图中还可以看出,P₄共形成了六个P-P共价键,分别位于白磷分子正面体结构的六条棱外部。
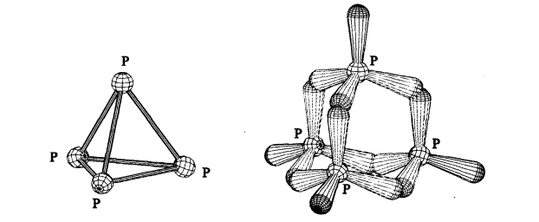
图1 白磷的几何结构和拓扑结构
理化性质
物理性质
化学性质
与单质反应
与氧气反应
白磷在空气中可以自燃,与空气中的氧气发生反应,白磷在空气中燃烧会产生大量的白烟,该反应的表达式如下:

与硫反应



与无机化合物反应
与水反应

白磷可以同时与水和氧气发生反应,生成磷酸或二磷酸,反应的表达式如下:


与酸反应



与碱金属氢氧化物反应

与氧化钙反应

与硫酸铜反应

白磷还可以与硫酸铜反应生成磷化铜,反应的表达式如下:

与有机化合物反应
白磷与碘代三氟甲烷在220 °C下加热48小时可以反应生成三氟甲基二碘化磷、双三氟甲基碘化磷和三三氟甲基磷,反应的表达式如下:

同素异形体
白磷转化为红磷表达式如下:

制备方法
实验室制法
红磷在416 °C的高温下可以转化为白磷,实验室里常采用该方法制备白磷。具体操作如下见下图:将红磷在干燥的二氧化碳气体中加热,并将导管的另一端插入饱和碳酸钠溶液中。之后加热红磷,当红磷全部升华为白磷后停止加热,生成的块状白磷取出加水密封保存。反应的表达式如下:
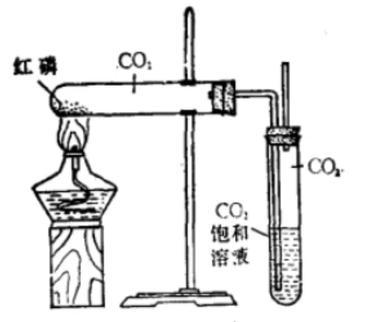
图2 白磷的简易制备装置

工业制法
高炉法
电炉法
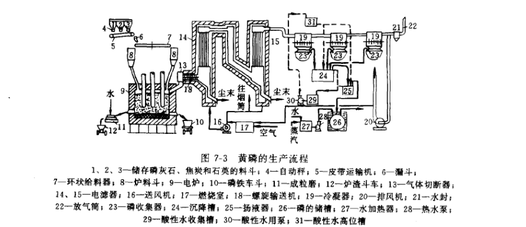
图3 电炉法生产白磷的工艺流程图

该过程中,生成的磷以P₂分子的状态逸出,之后结合成P₄分子。

其它制备方法
- 其它制备磷的方法还有流化床还原法、等离子体法、天然气或甲烷还原法等
提纯方法
水蒸气蒸馏法
酸洗法
用10%~20%的硝酸,在搅拌和加热至白磷为熔融状态下对市售的白磷进行多次洗涤。
应用领域
工业用途
军事用途
白磷在军事上可被用于制造燃烧弹、烟罐、烟雾弹以及示踪剂弹药等,但是白磷在军事上的用途受到国际法的限制。例如,1980年10月通过的《联合国常规武器公约》明确规定,禁止使用白磷弹等燃烧武器攻击平民或民用物品。
合金行业
食品行业
其他用途
白磷可以用作合金的添加成分;白磷可以用作发烟剂和引火剂;高纯度的磷可以用于电子和半导体工业;白磷还可以用于制造特种火柴、人造肥料和灭鼠剂等。
安全事宜
毒性
已经报道的数据显示,以鼠为实验对象,白磷的LD50(半数致死量)毒性数值如下:
LD50(雌性大鼠):口服3.03 mg/kg
LD50(雄性大鼠):口服3.76 mg/kg
LD50(雌性小鼠):口服4.82 mg/kg
LD50(雄性小鼠):口服4.85 mg/kg
危险性类别
自燃固体,类别1;急性毒性—经口,类别2∗;急性毒性—吸入,类别2∗;皮肤腐蚀/刺激,类别1A;严重眼损伤/眼刺激,类别1;危害水生环境—急性危害,类别1。
健康危害
白磷对人体的毒性极强,口服白磷会强烈损伤人体的肠胃系统、肾脏、肝脏、心血管系统和中枢神经系统等。吸入白磷蒸气会刺激人体呼吸道并引发咳嗽。人类长期接触白磷会导致下颌坏死。
白磷接触皮肤有可能会燃烧,严重灼伤皮肤。
白磷烟雾对人体的肺部、眼睛和皮肤有强烈的刺激性。
急性中毒
白磷的急性中毒多数是由内服引起的,急性中毒时会有腹痛、呕吐的症状,且伴随着腹泻、腹胀和头晕。白磷的急性中毒还可能导致心脏机能不全、心肌梗死以及各种心血管系统机能紊乱。一些患者在肠胃症状出现之前,就已经在意识丧失、心脏衰弱的情况下死亡。
慢性中毒
白磷慢性中毒会导致颌骨的坏死。慢性中毒引发的疾病有时会从剧烈的牙痛或龋齿周围的骨膜炎开始。慢性中毒还会引发患者出现食欲丧失、贫血、消瘦、发热等症状,一部分患者最后可能会死亡,另一部分患者虽然能恢复健康,但脸部可能变得畸形。白磷的慢性中毒会损害人体的肝脏,导致肝脏解毒功能降低,引发肝硬化。慢性中毒对人体呼吸器官的病变主要表现为鼻、咽、喉黏膜的萎缩性炎症,各种支气管炎以及中度肺气肿。白磷能透过胎盘,可能会造成流产。
白磷进入机体的途径、转化和排出
白磷可经呼吸道和灼伤的皮肤进入机体,在潮湿的黏膜,有部分的白磷可能转为为磷酸。白磷进入机体后一部分以元素状态存在于血液中,一部分被氧化,之后以这两种形态沉积于器官中。白磷可随呼出气、粪便、汗液排出体外。
防护措施
使用白磷的操作过程尽量实现机械化、自动化。操作人员要参加培训,严格遵守操作规程。操作人员要佩戴全面罩式的自吸过滤式防毒面具,穿戴胶布防毒衣和橡胶手套。操作现场应该使用防爆式的通风系统的设备。
白磷的工作现场应当禁止吸烟、进食以及喝水,工作完毕后,应该进行彻底的清洗工作。
对生产白磷的工作人员应该进行就业前的体检以及半年一次的定期体检;对于接触和使用白磷的工作人员,应该进行一年一次的定期体检。
急救措施
当由于内服引发白磷急性中毒时,要立即用高锰酸钾溶液或者硫酸铜溶液多次重复洗胃,直至洗出液中的白磷气味消失,在半小时内多次服用硫酸铜溶液,再用盐性轻泻剂重复清除性灌肠。之后服用碱性饮料(如NaHCO₃)以及粘稠的米汤,静脉注射加入了抗坏血酸、氯化钙(CaCl₂)溶液的葡萄糖。最后根据指征给予输血和强心剂,立即就医。注意在治疗过程中千万不能使用牛奶、蓖麻油、植物和动物脂肪等能溶解白磷的物质。
当吸入白磷引发中毒时,应当立即将患者转移至空气流通处,评估患者的呼吸功能和脉搏,确保患者呼吸没有受阻。当患者呼吸急促或呼吸困难时,要立即进行吸氧;当患者呼吸停止时,要立即进行人工呼吸并立即就医。
当隔着衣物接触白磷时,应当在流水下将燃烧部位的衣物剪开,再进行如上操作。
当白磷进入眼睛时,应当立即用大量流动冷水冲洗眼睛至少15分钟。
消防措施
白磷燃烧迅速,且会释放大量的白色刺激性烟雾。当白磷起火时,要立即对现场人员进行疏散,可以用水淋浇以控制现场火焰,然后用湿沙、粘土等覆盖。进行灭火行动时,要从上风向接近火灾,以避免危险蒸气和有毒分解产物对消防人员造成损害。要严格控制火灾现场的人员进出,条件允许的情况下最好让白磷自行燃烧。当火被灭后,要小心白磷在余热下重新点燃。
清理方法
当白磷出现泄漏时,应当立即隔离污染区,限制污染区人员出入,切断现场火源。现场的处理人员应当佩戴自给正压式呼吸器,穿戴防护服,切忌直接接触泄漏物。
当出现小量的白磷泄漏时,如果在实验室内可以直接在通风内将其燃烧掉或者用湿沙、泥土盖住,铲入金属容器内转移至安全的区域内烧掉。
当出现大量泄漏时,应该在相关专家的指导下处理。
储存运输
白磷的存储要杜绝空气,与氧化性物质、可燃物、酸类、卤素、食用化学品分开存放于阴凉、通风的仓库。白磷的存储必须远离火种和热源,采用防爆型照明、通风设备,禁止使用容易产生火花的机械设备和工具。存储白磷的容器要保持密封,白磷要密封在水里且必须浸没在水下或者储存于惰性气体中。白磷的储存区要备有合适的材料用于泄漏物的收集,严格执行极毒物“五双”管理制度。


