锂离子电池(一种二次电池)

VLoG
次浏览
更新时间:2023-05-19
锂离子电池
一种二次电池

锂离子电池(Lithium-ion Battery,LIB)作为二次电池(可充电电池)的代表,是目前应用最为广泛的电池。锂离子电池通常由正极、负极、隔膜、电解液、外壳等组成,循环时依靠锂离子通过内电路在正极与负极之间的嵌入和脱嵌以及电子在外电路的往返来实现充电与放电。根据正极材料、包装以及用途都可对其分类,锂离子电池在长期的充放电循环下,内部会产生一系列的副反应,包括析锂、固体电解质界面(SEI)膜生长等,降低电池的容量,当电池容量降低至初始容量的80%时,即定义为电池一次寿命的终结。其特点是比能量高、寿命长、工作电压高、使用温度范围广、无记忆效应、自放电小以及对环境友好,因此广泛应用于新能源汽车、电网储能以及便携式电子设备等领域中。
基本信息
中文名
锂离子电池
英文名
Lithium-ion Battery
运用领域
汽车、电网储能、便携式电子设备
功能
化学能与电能之间的相互转化
组成部分
正极、负极、隔膜、电解液(质)
应用学科
电化学
发展历史
20世纪50年代美国国防部和美国国家航空航天局(National Aeronautics and Space Administration,NASA)以金属氟化物为正极、锂金属为负极研究高能量密度的电池,但由于锂枝晶等原因性能并不理想。
20世纪70年代,美国埃克森美孚公司(Exxon Mobile)的惠廷汉姆(Whittingham)领导科研团队发现锂离子可以再



1980年,美国得州大学奥斯汀分校机械工程系古迪纳夫(Goodenough)团队从材料中优选出

1982年,伊利诺伊理工大学的研究者阿加瓦尔(Agarwal)和塞尔曼(Selman)发现了锂离子能够嵌入石墨,且能够改善之前锂电池的安全性,贝尔实验室研制成功了首个可用的锂离子石墨电池。
1990年日本索尼公司正式将以石墨材料为负极,含锂化合物为正极的锂电池商业化,并区分于金属锂负极的锂电池,正式命名其为锂离子电池。
21世纪以后,在科学家们的努力下,更高比容量的三元系正极材料陆续出现,含不同比例Ni、Co、Mn、Al的过渡金属氧化物陆续出现,推动了锂离子电池的发展。
2019年,诺贝尔化学奖颁发给了在锂离子电池发展的历史长河中做出突出贡献的古迪纳夫、惠廷汉姆以及日本研究者吉野(Yoshino)教授。
工作原理
锂离子电池,作为一种电化学储能装置,其工作过程是电能和化学能相互转化的过程,其本质是一种浓差电池,又被称为“摇椅式电池”,当电池充电时,外部施加的电压使正极中的锂离子脱嵌,经过电解液穿过隔膜流向并嵌入负极,同时为了保持电中性,正极的电子也经过外电路流向负极,随着锂离子不断从正极材料中脱嵌,又嵌入负极,正极电位不断升高,负极电位不断降低,导致电池电压(正极电位减去负极电位)不断升高直至达到充电截止电压。
当电池施加外部负载进行放电时,由于正、负极之间的电位差,锂离子从负极脱嵌,经过电解液通过隔膜又流向并嵌入正极,随锂离子的脱出负极电位逐渐增加,正极电位不断降低,使电池电压不断降低,负极电子也经过外电路流向正极,直至达到放电截止电压,工作原理如下图所示。
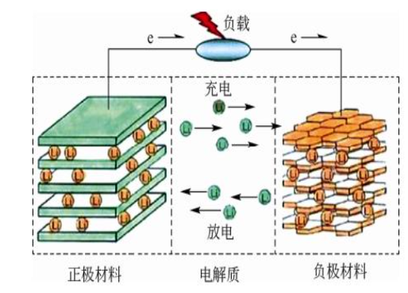
锂离子电池充放电工作原理
正极反应:

负极反应:

总反应:

理想情况下,锂离子的嵌入和脱嵌不会对活性材料的结构造成影响,因此,理想情况下该反应是可逆的。组成结构
正极
锂离子电池的正极由正极活性材料、粘合剂、导电剂和集流体组成,正极活性材料是最重要的组成部分,其提供了电池循环时所需要的锂离子,不仅要参与电池内部发生的电化学反应,嵌入和脱嵌锂离子,还要进行电子的传输以保持其电中性。同时,由于负极的实际克容量要大于正极材料的实际克容量,电池设计时需要使两极容量保持一致,正极材料必须占有更大比例,正极材料的性能和成本很大程度的影响着电池整体的性能和成本。
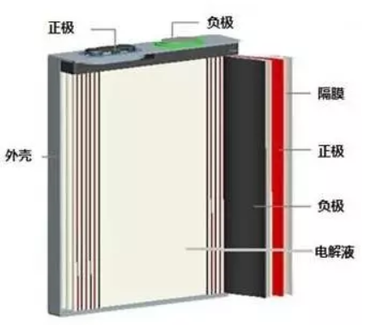
锂离子电池组成结构
正极活性材料:电池的输出电压和可用容量决定了电池所能够储存的能量,为了尽可能提高电池性能以及寿命,正极活性材料需要满足以下要求:
- 有着较高的氧化还原电位,从而增大与负极之间的电位差,提高电池的输出电压。
- 能够尽可能多的嵌入锂离子,可循环锂离子的量决定了电池的可用容量。
- 在锂离子嵌入正极或者从正极脱嵌时,正极材料的结构尽可能不发生改变,以提高电池的寿命和可靠性。
- 成本低,环境友好。
- 化学稳定性、热稳定性好,不与电解液发生反应。
常用的正极材料包括:钴酸锂(









负极
锂离子电池的负极由负极活性材料、粘合剂、导电剂和集流体组成,负极活性材料是最重要的组成部分,与正极活性材料相似,需要参与锂离子的嵌入与脱嵌、电子的传输,但电池刚组成时,负极不含锂离子,锂离子都在负极。理想的负极活性材料需要满足以下要求:
- 能够嵌入锂的容量大,从而提高电池的容量。
- 锂在负极活性材料中扩散性好,以承受大电流的充、放电。
- 导电性好,防止电极的极化。
- 在嵌锂和脱锂时,不会对活性材料结构造成影响。
- 成本低、稳定性好、易制取、环境友好。
自1990年索尼公司商业化生产以来,大规模商业化应用的负极材料就一直是石墨,石墨具有着完整的层状晶体结构,还有着成本较低、结构稳定性高、无毒性、导电性好、机械性能好等等各个方面的优点。在许多应用场景都能取得较好的效果。
但随着行业对电池性能要求的进一步提高,石墨负极锂离子电池在大功率设备中应用时,存在功率低、安全性差等缺点。在科研以及高新产品领域,已经出现了新一代锂离子电池负极材料,以满足对大功率应用电池的需求。2005 年,索尼公司推出了技术安全且低成本的 Sn/Co/C 的非晶/纳米晶体复合物负极材料,稳定可逆容量可高达450mA·h/g,推动了一系列新型负极材料(硅基材料、钛基材料、金属氧化物和硫化物)的快速发展。
隔膜
锂离子电池内部的隔膜通常有两个作用:
- 通过绝缘的隔膜将电池的正极和负极隔开,防止内短路的发生。
- 隔膜内部的离子通道能够让电解液中的离子自由通过,保证电池在充放电循环时内部形成正常的电流回路。
电解液(质)
电解液 (质)的作用是在电池电化学反应过程中在正、负极之间完成离子的传输。由于锂离子电池负极电位与锂接近,比较活泼,在水溶液体系中不稳定,因此锂离子电池电解液(质)使用非水、非质子有机溶剂作为离子的载体,电解液需要有足够的电导率、热稳定性、化学稳定性以及成膜特性,还应满足低成本、易制备、环境友好的特性。
外壳
外壳的主要作用是作为电池的容器,保护电池内部材料,由于锂离子电池在实际应用时经常会受到外部压力的作用,需要通过外壳增加电池机械强度,避免电池内部材料的变形(尤其是隔膜,刚度最低),影响电池的安全和寿命,通常选用优质铝材作为电池外壳材料。
优缺点
优点
能量密度大:锂离子电池的工作电压高,且锂密度低,因此锂离子电池的质量能量密度(200Wh/kg)和体积能量密度(350Wh/L)都很大,是铅酸电池(50-70Wh/kg)的3倍。
循环寿命长:实际应用中的锂离子电池可以循环充放电1000次以上。
无记忆效应:不会由于未放完电就充电导致电池容量下降。
工作温度范围宽:-20℃-60℃。
缺点
成本较高:是同容量的铅酸电池价格的3-4倍。
低温性能差:采用有机溶液作为电解液,使其低温性能受限,低温充电易在负极产生额外的过电位,引起析锂的发生,影响电池寿命和安全。
过充电性能差:充电电压超过一定值,电解质、电极活性材料等由于热稳定差会发生分解,释放大量热,影响电池安全。
安全性较差:能量密度高导致其故障瞬间释放大量能量,容易引起爆炸等剧烈的安全事故。
分类
按封装形式分
锂离子电池根据封装形式分为圆柱、方形和软包电池,电池封装形式与制造方法、产品性能密切相关,下表对其进行了对比:

不同封装的锂离子电池
封装形式 | 制造工艺 | 优点 | 缺点 |
圆柱 | 圆柱卷绕 | 小尺寸、成组灵活、工艺成熟、一致性好 | 散热不好设计、重量大、比能量低 |
方形 | 方形卷绕 | 散热好、可靠性好、含防爆阀更安全、高硬度 | 尺寸固定、成本高 |
软包 | 方形层叠 | 尺寸灵活、比能量高、重量轻、内阻小 | 机械强度差、封口工艺难、散热设计不易、一致性差、成本高 |
按正极材料分
根据正极材料的不同分为钴酸锂、锰酸锂、磷酸铁锂以及三元系锂离子电池,不同正极材料优缺点对比:
优点 | 缺点 | 应用 | |
钴酸锂 | 放电电压高 性能稳定 易于合成 | 钴资源稀少 价格较高 有毒污染环境 | 手机和笔记本等中小容量电子产品 |
锰酸锂 | 成本较低 环境友好 | 循环寿命较低 | 电动工具 医疗设备 |
磷酸铁锂 | 比能量较大(90-120Wh/kg) 价格低环境友好 安全性好 循环寿命长 | 电导率低 | 电动汽车动力电池等要求高负载和耐久性和应用场景 |
三元系 | 工作电压高 比能量大(150-220Wh/kg) | 安全性略低 Co元素成本较高且污染环境 | 电动车动力电池 工业领域 |
按用途分
动力型锂离子电池:主要应用于对功率密度和能量密度都有一定要求的场景,需要长时间提供能量,且有时需要瞬时的较大电流,例如纯电池汽车。
功率型锂离子电池:不需要长时间的工作,但需要提供瞬时的巨大电流,典型的使用案例是主要依靠发动机驱动、电机用来提速以及制动回收的混合动力汽车。
老化机理
锂离子电池的老化是其循环老化和日历老化(长时间搁置)综合影响的结果,是一个非常复杂且长期的过程,内部许多类型的物理、化学过程都会导致电池的老化,包括固体电解质界面膜(SEI)形成、析锂等等。
SEI生长
在电池第一次充电(化成)过程中,会在负极与隔膜的界面消耗10%的锂形成初始的SEI膜,之后在电池的整个生命周期内经历构成、生长、分解和再生的循环过程,SEI膜是锂离子与电解质中多种组分发生的一系列反应的产物,会造成可循环锂的减少从而降低电池容量。
析锂
当电池处于低温、高倍率、过充的工况,负极对锂电位降低至0V以下时,一部分锂离子仍然正常的嵌入石墨,另一部分锂离子则会在石墨表面以锂金属的形态析出,即析锂,不仅会引起可循环锂的减少,析出的锂还会以树突状生长,可能刺穿隔膜,引起严重的安全隐患——内短路。
安全故障
锂离子电池作为一个高比能量的储能设备,由于制造过程中材料本身、结构设计的缺陷,本身存在着一定的危险。电池的工作环境也非常复杂,除了频繁的碰撞,振动和冲击,电池系统在工作时还会释放大量的热,这都会造成一些安全隐患。锂离子电池的安全性失效模式包括内短路、外短路、过充/过放等等。
内短路
电池的内短路指的是当电池的正负极材料在电池内部形成电连接、由于电位差引发放电并且伴随着大量的热释放的现象,电池内短路时,电池中大量的能量会在很短的时间内被释放出来,使电池快速升温,甚至引起电池的爆炸。
外短路
与内短路不同,电池的外短路是指电池外部的正、负极极柱直接形成电连接,电池通过极小的电阻进行放电,使电池内储存的化学能以热能的形式散出,使电池快速升温,但相比内短路峰值温度更低。外短路通常是由电池系统的碰撞变形、水浸和连接故障导致的。
过充/过放
过充(过放)指的是在电池充满电(放空电)后仍然继续给电池充电(放电),快充(放)、充(放)电后期大倍率充(放)电都可能导致过充(放),轻微的过充(放)仅会导致电池可用容量的略微下降,长时间的过充(过放)则会影响电池的安全。
安全事宜
锂离子电池在正常使用过程中不会对人体和环境造成危害,但在报废时如果不正常预处理(放电、拆解、粉碎、分选)就会对环境造成危害,进而影响到周边的生物和人体。
锂离子电池活性材料中的钴、电解液中的六氟磷酸锂以及隔膜中的聚丙二乙烯等会对环境造成有机污染,在废弃时需要先将其放至空电,拆解回收塑料以及铁外壳,对电极材料进行碱浸出、酸浸出,之后在进行萃取,电池中的电解质、电极液及一些转化、水解产物(六氟磷酸锂、氟化氢、甲醇、甲酸等)都需要送至有资质的地方进行统一解决,不能随意丢弃,关键电极材料的回收不仅能够降低对环境的污染,还能减少对锂、钴等资源的依赖,有着重要的社会意义和经济意义。
锂离子电池通常在其容量下降至80%时即为一次寿命的结束,但若将其直接报废,会造成严重的资源浪费,可以通过梯次利用来让电池在多个应用场景下得到长期的利用。电池出厂后,首先在电动汽车上应用,一次寿命结束后,可以将其应用在对功率要求不高的电网储能系统中,一方面延长电池使用寿命,另一方面降低电池的成本。
应用领域
汽车领域
为了响应国家的双碳政策,解决能源短缺以及环境污染的问题,汽车行业需要实现从燃油车向电车的转型,锂离子电池以其高能量密度、高工作电压、长循环寿命等优点,无论是在电动轿车上还是在电动公交车上得到了广泛的应用,尤其是磷酸铁锂电池和三元系电池。
电网储能领域
为了进一步降低对不可再生能源(煤、石油、天然气)的依赖,可再生能源(风能、太阳能等)的发电受到了广泛的关注,但这些可再生能源发电存在着一定的波动性和间歇性,不能直接将获取的电能传输到电网上,会造成电网的波动,因此需要通过储能电池储存一部分可再生能源转换的电脑,在电网侧负载较高时供给电能,实现电网的调频与调峰。
储能电池对于能量密度没有直接的要求,但不同的储能场景(调频、调峰)对电池的功率密度有要求,长寿命、高能量转换效率的锂离子电池可以担此重任。
便携式电子设备领域
近年来,随着互联网、物联网、大数据等技术的兴起,出现了越来越多的电子设备,便利了居民的生活,各种智能手机、MP3、MP4、摄影机、遥控器、儿童玩具等电子设备都出现了锂离子电池的身影。
发展趋势
中国作为全球锂离子电池发展最活跃的地区,锂离子电池市场规模逐年增长,新能源汽车是带动锂离子电池快速增长的最大引擎,储能市场对锂离子电池的需求也有望提速,除满足国内需求外,也将批量出口到欧美、澳洲、东南亚等地。




