胆红素(链状四吡咯环类化合物,胆色素的一种)

VLoG
次浏览
更新时间:2023-05-19
胆红素
链状四吡咯环类化合物,胆色素的一种
胆红素的其中一种结构式
胆红素(Bilirubin),又名胆深红、胆红质,是一种含有四吡咯环的有机物,分子式为C₃₃H₃₆N₄O₆。在常温常压下,胆红素是一种淡橙色至棕色的粉末,在标准大气压下,沸点为925.2±65.0 °C,20 ℃时密度为1.374 g /cm³,胆红素无臭无味,不溶于水,溶于苯、氯仿、二硫化碳、碱液及脂肪,难溶于醇、醚。由于胆红素的异构体数量较多,不同异构体的熔点也不同。
基本信息
中文名
胆红素
英文名
bilirubin
别名
胆深红、胆红质
拼音
dǎn hóng sù
CAS编号
635-65-4
性质
化学式
C₃₃H₃₆N₄O₆
摩尔质量
584.7g/mol
外观
粉末
气味
无臭无味
溶解性
不溶于水,溶于苯、氯仿、二硫化碳、碱液及脂肪,微溶于乙醇、乙醚
胆红素是胆色素的其中一种,存在于人体胆汁内,为胆汁的主要色素,其在血液中运输的方式是与血浆清蛋白结合成血胆红素,而后在肝脏细胞中被转化代谢。胆红素可以通过荧光法、氧化酶法等进行检测,胆红素对多种疾病的治疗潜力很大,也是判定黄疸和肝功能的重要依据。胆红素有毒性,正常浓度的胆红素是一种内源性的强氧化剂,不会损害细胞,血清胆红素含量超过17.1 μ mol/L为高胆红素血症,临床表现为黄疸。
研究历史
1847年Vichow首次发现胆红素,1883年Ehrich发现胆红素偶氮反应。1913-1916年van den Bergh发现了直接和间接胆红素。1942年,德国化学家汉斯·费歇尔(Hans Fischer)首次确定了胆红素的化学结构,该发现以及血红素合成等研究使其获得了1930年诺贝尔化学奖。1956年Watson将van den Bergh试验应用于临床。1976年,科学家们利用结晶法进一步研究了胆红素结构。
物质结构
固体结构
胆红素是一种极化的亲脂性化合物,其分子式为C₃₃H₃₆N₄O₆,其中包含由3个碳桥联系着的4个被取代的吡咯环结构,这4个吡咯环通过分子中央的2-次甲基桥相连。胆红素是非平面结构能够形成分子间氢键,且由于分子中有2个丙酸基侧链,胆红素呈弱酸性,能溶于碱溶液。
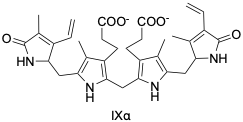
胆红素具有几十种异构体,其中四种常见的异构体为IXα、IXβ、IXγ、IXδ,人类和动物体内存在的主要是IXα型胆红素。
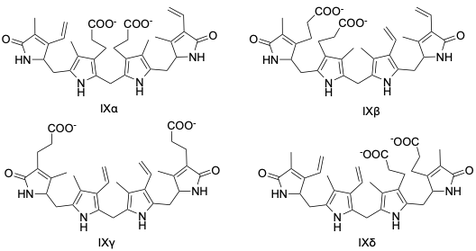
胆红素的四种常见异构体
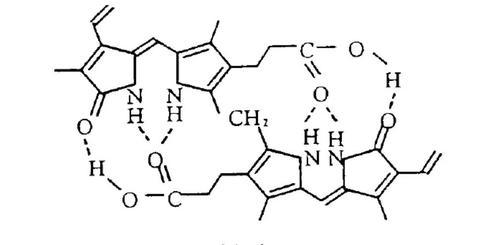
固态胆红素分子内氢键示意图
溶剂中的结构
下图为固态胆红素、氯仿胆红素和二甲基亚硫(DMSO)红外光谱中的胆红素。从图中很容易看出,固体胆红素和在溶液中的胆红素具有不同的红外光谱特征,这表明溶剂会影响胆红素结构且不同溶剂的影响效果具有差异性。接下来具体介绍胆红素在氯仿和DMSO溶液中的结构。
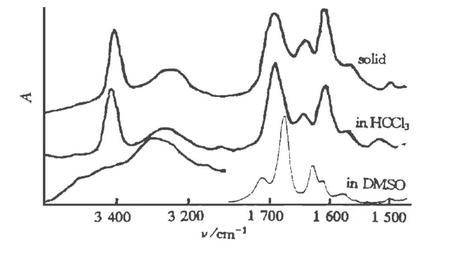
不同溶剂中胆红素的红外光谱
氯仿溶液中的结构
氯仿溶液中胆红素的红外特征峰形状和强度几乎与固态胆红素的一致,但是吡咯环和内酰胺的NH伸缩振动谱带都发生了轻微的位移,从中可知氯仿的溶剂化作用使胆红素的结构发生了改变。而且由于氯仿的给质子作用,改变了胆红素分子中氢键的形成方式和数量,固体胆红素分子中原有的六个氢键被破坏并形成了四个新的氢键,氢键数量减少使得氯仿中的胆红素化学性质更加活泼。
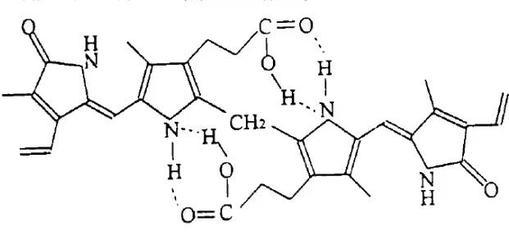
氯仿中胆红素分子内氢键示意图
DMSO中的结构
在二甲基亚砜(DMSO)溶剂中,胆红素的红外特征峰的峰位、峰形和相对强度与固态胆红素相差巨大。这是由于DMSO是质子受体溶剂,能够与分子内的吡咯、内酰胺以及羧基形成氢键。因此,原本固态胆红素的六个氢键全部被破坏,重新形成了DMSO与内酰胺、羧基之间的氢键(见下图)。这使得胆红素的分子结构发生了改变,也具有更加活泼的化学性质。
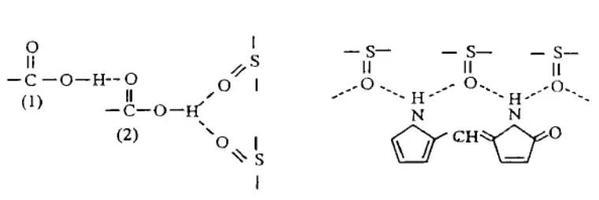
DMSO与COOH和NH的分子间氢键示意图
理化性质
物理性质
外观气味
胆红素无臭无味,外观为淡橙色至棕色粉末,在氯仿中呈精细的叶状体。
溶解性
稳定性
胆红素不稳定,将干燥的固体胆红素以及在氯仿溶液中的胆红素置于暗处,添加维生素C和乙二胺四乙酸(EDTA)能增强胆红素的稳定性。
化学性质
酸性
胆红素上具有两个丙酸基团和两个内酰胺结构,因此胆红素具有一定的酸性。胆红素(IXα)的滴定可以分两步进行,第一步是对丙酸羧基上的氢进行滴定,第二步是对内酰胺氮原子上的氢进行滴定。滴定结果为两个羧基的PK1和内酰胺上氨基的PK2分别为4.0和13.0。这个结果表明,胆红素分子中丙酸基团上的羧酸氢呈中等酸度,而内酰胺上的NH氢呈弱酸性。此后,许多科学家对胆红素(IXα)分子的酸性都进行过研究,结果各有差异。
氧化分解
胆红素易氧化分解,其在碱液、强酸、空气中很容易被氧化。胆红素结构中的四个分子内氢键在氯仿等非极性溶剂中稳定,在乙醇等极性溶剂中氢键容易被破坏进而变得不稳定。
见光分解
光线能破坏胆红素的双键,在强光下胆红素易分解变质,需要避光干燥保存。
显色性
生成与提取
来源
人体中70%的胆红素来源于衰老的红细胞被分布于脾、肝、骨髓中的网状内皮系统捕获、破坏产生的血红蛋白。其中肝脏微粒体酶蛋白/血红素的更新率较高,肝细胞中微粒体的细胞色素P450和b5、色氨酸、吡咯酶、线粒体的细胞色素b的代谢更新也是胆红素的主要生成途径之一,由肝产生的胆红素占23-37%。
还有10-20%的胆红素是通过其他途径产生的,比如约有9%的胆红素来自发育不良的红细胞。
生成
胆红素的生成过程:衰老的红细胞被来自肝、脾、肾以及骨髓的单核吞噬细胞系统破坏,血红蛋白分解为珠蛋白和血红素,血红素在血红素加氧酶(MHO)的作用下,bo环上的α-次甲基桥氧化断裂并释放出铁和一氧化碳生成胆绿素。细胞液中活性很高的胆绿素还原酶可以使得胆绿素被NADPH+H⁺还原成胆红素。
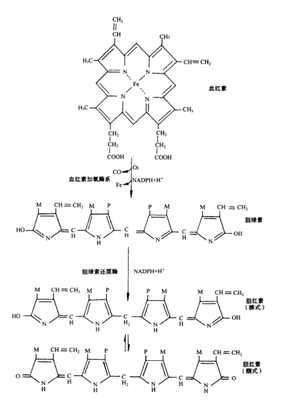
胆红素形成
提取
目前,直接从动物胆汁中提取胆红素是获取胆红素的最重要手段之一,具体步骤如下先对原材料进行杀菌处理,并将其中的脂肪酸等去除干净,以免影响体系的酸碱度,然后过滤得到滤液。将所得到的滤液水浴加热,并加入碱液发生皂化反应。再经过中和、萃取分层等步骤得到胆红素。不同科学家虽使用的工艺大致相同,但具体的条件又各有差异,例如原材料、溶剂、萃取家和抗氧化剂的选择、原材料的处理程度、皂化温度和时间等,这些条件均会影响提取胆红素的质量和效率。例如体系溶剂的选择十分重要,pH应在10-11之间,若溶剂的pH值过小则胆红素易被氧化,若pH值过大则产率低。如皂化时间对胆红素的提取也有较大的关系,皂化时间并不是越长越好,因为胆红素会溶解于碱性溶液中,反应时间越长产率越低。
代谢
运输
网状内皮系统中生成的胆红素是亲脂的,能透过细胞膜进入血液。胆红素在血液中的运输形式主要是与血浆清蛋白结合为血胆红素,这样能够增加胆红素的溶解度并且限制其对组织的毒害,少量胆红素会与α₁球蛋白结合。正常人血胆红素含量约为0.1-1.0 mg/dL,并且每100 ml血浆中的血清蛋白可以结合20-25 mg游离胆红素,所以游离胆红素不会进入组织细胞进而产生毒副作用。
转化
胆红素在肝脏中转化包括肝细胞对胆红素的摄取、胆红素在肝细胞内的运载、结合胆红素的形成、胆红素排泄等一系列过程。首先,与清蛋白结合的胆红素可以穿越肝窦内皮细胞之间的空隙,当胆红素接触肝细胞侧膜后,迅速与清蛋白中分离,并被肝细胞所摄取。胆红素进入肝细胞后立即与Y蛋白(配体蛋白)或Z蛋白等载体蛋白结合,此时蛋白质就不能再流出肝细胞外。载体蛋白将胆红素运载至滑面内质网,在UDP-葡萄糖醛酸转移酶的作用下,形成结合胆红素(CB),即胆红素单葡萄糖醛酸酯(BMG)和胆红素双葡萄糖醛酸酯(BDG)。未经过肝脏转化的胆红素虽然能与血液中的清蛋白结合,但仍称为未结合胆红素,未结合胆红素不能由肾小球滤过。结合胆红素(CB)的水溶性增加,最后从毛细胆管排入到胆汁中。
肝细胞转化生成的结合胆红素会随胆汁排入肠道,在大肠杆菌的作用下大部分胆红素会脱去葡萄糖醛酸并逐步被还原成胆素原(包括胆素原、粪胆素原、d-尿胆素原)。在肠道下段,无色的胆素原接触空气后会被氧化成黄褐色的胆素(包括L-尿胆素、粪胆素、d-尿胆素),胆素是粪便的主要色素。肠道梗阻时,粪便会因为结合胆红素不能排入肠道转化为胆素原和胆素而呈现灰白色。
循环
肠道中约10-20%的胆素原能够被肠黏膜细胞重新吸收,并且大部分会随胆汁进入肠道,实现胆素原肠肝循环。少量胆素原会进入肾并随尿液排出,胆素原被氧化后呈黄色是尿液的主要色素。
检测方法
荧光法
在一定范围内,胆红素的浓度与荧光强度呈良好的线性关系,因此可利用荧光强度判断溶液中胆红素浓度。例如胆红素可以与二甲亚砜(DMSO)剧烈反应,反应一段时间后,以不含乙酸锌的反应液为参比检测反应溶液的荧光强度。也可将血清与H₃PO₄ 85%,在反应1分钟或更长一段时间后加入水,并在过滤器荧光计中测量荧光,此方法更为简便、灵敏,不仅适用于测试血清中的胆红素,尿液中同样适用。
氧化酶法
胆红素氧化酶法测定血清胆红素的原理是基于胆红素氧化酶在不同pH条件下可以催化不同种类的胆红素,如在具有分子氧的体系内,胆红素可在胆红素氧化酶的催化下氧化成胆绿素,这种方法可以检测人体中总胆红素、结合胆红素等。当含有胆酸钠和十二烷硫酸盐的反应液的pH接近8时,胆红素的四种构型均可以被氧化为胆绿素,之后胆绿素将继续被氧化为紫色产物,最终变为无色。450 nm处的吸光度的下降值与人体内总胆红素浓度呈比例。
生理功能
转运和排泄血红素等物质的代谢产物
衰老的红细胞被破坏后,血红蛋白分解产生的原卟啉无法被再利用,必须及时排除体外,正常的血清胆红素水平能够保证原卟啉的转运和排泄正常进行。
抗自由基
血红素分解后会生成胆绿素IXα,胆绿素IXα在胆绿素还原酶和还原型辅酶II的作用下会被还原成胆红素IXα。胆红素IXα在氧化还原反应中能提供2个氢原子,这使得胆红素具有抗自由基的性能。当细胞膜上的脂质形成不饱和脂肪酸自由基时,胆红素能与之反应,形成非自由基产物,进而避免细胞的损害。
保护心血管
引起冠状动脉粥样硬化的主要因素之一是血脂异常,尤其是血胆固醇浓度升高,而增高的血清胆红素能明显降低血清脂质和脂蛋白,从而保护心血管。胆红素水平降低,有可能导致氧化性脂蛋白增加,不利于胆固醇的溶解和清除,进而导致血清内胆固醇含量增加。
抗变态反应
安全事宜
健康危害
胆红素为脂溶性化合物极易传过细胞膜,有毒,其毒性作用主要为引起大脑不可逆的损害。正常浓度下的胆红素是一种内源性的强抗氧化剂,不会对细胞造成损害。一般血清胆红素水平超过17.1 μ mol/L为高胆红素血症,其临床症状表现为黄疸。系统性胆红素过多,胆红素经肝细胞转运功能障碍,肠道对胆红素吸收增强,毛细胆管对葡萄糖醛酸胆红素的分泌受限等均能引起黄疸。传统的黄疸可分为溶血性黄疸、肝细胞性黄疸、阻塞性黄疸、胆汁淤积性黄疸。此外还有新生儿黄疸,其发病原因较为复杂,可分为生理性(胎儿时期的无效造血导致血清胆红素水平过高)和病理性黄疸(病因有母婴血型不合导致溶血性黄疸、先天性胆管闭锁导致胆道发育异常等),有引发核黄疸(胆红素脑病)的巨大危害。先天性黄疸常在婴幼儿时期发病,多为遗传性肝脏疾病,可分为非结合性高胆红素血症和结合性高胆红素血症。
异常代谢
胆红素异常代谢的原因有很多,常见的有以下几种:
1.血溶性黄疸会使人体内的胆红素增多。当人体的红细胞自身出现缺陷,如酶缺失、血红蛋白异常等;或大量红细胞受外部原因而被破坏,如原虫感染导致的疟疾、细菌感染导致的霍乱、磺胺类药物、硝基呋喃类药物、奎尼丁、噻唑酮等药物因素。大量红细胞损伤的这将导致血液中大量的胆红素无法被结合,从而引起高胆红素血症(黄疸)。
2.由于新生儿的肝脏发育尚未完全,肝细胞内的载体蛋白较少,这导致肝细胞对胆红素的摄取减少。
4.先天性肝细胞结合胆红素障碍:杜宾–约翰逊综合征(Dubin-Johnson Syndrome)、罗托综合征(Rotor Syndrome)、吉伯特氏综合征(Gilbert Syndrome)
/克里格勒-纳亚二氏综合征(Crigler-Najia)等
5.药物性黄疸:一些药物可以和胆红素竞争与肝细胞中的Z、Y载运蛋白的结合,使得胆红素的摄取和转运降低。


