蛋白质折叠(蛋白质折叠)

VLoG
次浏览
更新时间:2023-05-22
基本信息
| 中文名 | 蛋白质折叠 |
| 基本单位 | 氨基酸 |
| 理论模型 | 框架模型、疏水塌缩模型等 |
| 特点 | 亲水性、疏水性、带正电 |
生物简介
蛋白质折叠
蛋白质折叠的研究,比较狭义的定义就是研究蛋白质特定三维空间结构形成的规律、稳定性和与其生物活性的关系。在概念上有热力学的问题和动力学的问题;蛋白质在体外折叠和在细胞内折叠的问题;有理论研究和实验研究的问题。这里最根本的科学问题就是多肽链的一级结构到底如何决定它的空间结构?既然前者决定后者,一级结构和空间结构之间肯定存在某种确定的关系,这是否也像核苷酸通过“三联密码”决定氨基酸顺序那样有一套密码呢?有人把这设想的一级结构决定空间结构的密码叫作“第二遗传密码”。
蛋白质
蛋白质是一种复杂的有机化合物,旧称“朊(ruǎn)”。氨基酸是组成蛋白质的基本单位,氨基酸通过脱水缩合连成肽链。蛋白质是由一条或多条多肽链组成的生物大分子,每一条多肽链有二十至数百个氨基酸残基(-R)不等;各种氨基酸残基按一定的顺序排列。蛋白质的氨基酸序列是由对应基因所编码。除了遗传密码所编码的20种基本氨基酸,在蛋白质中,某些氨基酸残基还可以被翻译后修饰而发生化学结构的变化,从而对蛋白质进行激活或调控。多个蛋白质可以一起,往往是通过结合在一起形成稳定的蛋白质复合物,折叠或螺旋构成一定的空间结构,从而发挥某一特定功能。合成多肽的细胞器是细胞质中糙面型内质网上的核糖体。蛋白质的不同在于其氨基酸的种类,数目,排列顺序和肽链空间结构的不同。
蛋白质结构
蛋白质分子的结构决定了它的功能。
二级结构:蛋白质分子局区域内,多肽链沿一定方向盘绕和折叠的方式。
连接方法:用约20种氨基酸作原料,在细胞质中的核糖体上,将氨基酸分子互相连接成肽链。一个氨基酸分子的氨基,脱去一分子水而连接起来,这种结合方式叫做脱水缩合。通过缩合反应,在羧基和氨基之间形成的连接两个氨基酸分子的那个键叫做肽键。由肽键连接形成的化合物称为肽。
蛋白质折叠
蛋白质折叠
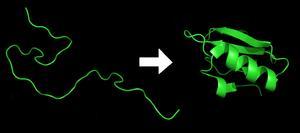
根据克里斯琴·B·安芬森(1972年的诺贝尔化学奖得主)的研究,蛋白质可由加热或置于某些化学环境而变性,三级结构解体;而当环境回复到原本的状态时,蛋白质可于不到一秒的时间折叠至原先的立体结构,不论试验几次,蛋白质都仅此一种立体结构,于是Anfinsen提出一个结论:蛋白质分子的一级结构决定其立体结构。
安芬森的研究结果非常重要,因为蛋白质的功能取决于其立体结构,而目前根据已知某基因序列可翻译获得对应蛋白质的氨基酸序列,既蛋白质的一级结构;如果从蛋白质的一级结构就能知道立体结构,那么即可直接从基因推测其编码蛋白质所对应的生物学功能。虽然蛋白质可在短时间中从一级结构折叠至立体结构,研究者却无法在短时间中从氨基酸序列计算出蛋白质结构,甚至无法得到准确的三维结构。因此,研究蛋白质折叠的过程,可以说是破译“第二遗传密码”——折叠密码(foldingcode)的过程。
目前蛋白质的再折叠依然遵从先使用胍或脲变性,然后逐渐降低降低胍或者脲的浓度,也就是逐渐降低对蛋白质天然“回缩”能力的干扰。使其自然回到天然的最低能量状态。只是这个过程无法很好的控制肽链与肽链之间和肽链内部形成错误折叠的干扰。
在生物体内,生物信息的流动可以分为两个部分:第一部分是存储于DNA序列中的遗传信息通过转录和翻译传入蛋白质的一级序列中,这是一维信息之间的传递,三联子密码介导了这一传递过程;第二部分是肽链经过疏水塌缩、空间盘曲、侧链聚集等折叠过程形成蛋白质的天然构象,同时获得生物活性,从而将生命信息表达出来;而蛋白质作为生命信息的表达载体,它折叠所形成的特定空间结构是其具有生物学功能的基础,也就是说,这个一维信息向三维信息的转化过程是表现生命活力所必需的。
结构决定功能,仅仅知道基因组序列并不能使我们充分了解蛋白质的功能,更无法知道它是如何工作的。蛋白质可凭借相互作用在细胞环境(特定的酸碱度、温度等)下自己组装自己,这种自我组装的过程被称为蛋白质折叠。
蛋白质折叠问题被列为“21世纪的生物物理学”的重要课题,它是分子生物学中心法则尚未解决的一个重大生物学问题。从一级序列预测蛋白质分子的三级结构并进一步预测其功能,是极富挑战性的工作。
自从20世纪60年代,Anfinsen基于还原变性的牛胰RNase在不需其他任何物质帮助下,仅通过去除变性剂和还原剂就使其恢复天然结构的实验结果,提出了“多肽链的氨基酸序列包含了形成其热力学上稳定的天然构象所必需的全部信息”的“自组装学说”以来,随着对蛋白质折叠研究的广泛开展,人们对蛋白质折叠理论有了进一步的补充和扩展。Anfinsen的“自组装热力学假说”得到了许多体外实验的证明,的确有许多蛋白在体外可进行可逆的变性和复性,尤其是一些小分子量的蛋白,但是并非所有的蛋白都如此。而且由于特殊的环境因素,体内蛋白质的折叠远非如此。
体内蛋白质的折叠往往需要有其他辅助因子的参与,并伴随有ATP的水解。因此,Ellis于1987年提出了蛋白质折叠的“辅助性组装学说”。这表明蛋白质的折叠不仅仅是一个热力学的过程,显然也受到动力学的控制。有的学者基于有些相似氨基酸序列的蛋白质具有不同的折叠结构,而另外一些不同氨基酸序列的蛋白质在结构上却相似的现象,提出了mRNA二级结构可能作为一种遗传密码从而影响蛋白质结构的假说。但目前为止,该假说尚没有任何实验证据,只有一些纯数学论证。那么,蛋白质的氨基酸序列究竟是如何确定其空间构象的呢?围绕这一问题科研人员已进行了大量出色的工作,但迄今为止我们对蛋白质的折叠机制的认识仍是不完整的,甚至有些方面还存在着错误的观点。
蛋白质折叠病

蛋白质折叠
研究蛋白质的折叠,是生命科学领域的前沿课题之一。蛋白质是一种生物大分子,基本上是由20种氨基酸以肽键连接成肽链。肽链在空间卷曲折叠成为特定的三维空间结构,包括二级结构和三级结构二个主要层次。有的蛋白质由多条肽链组成,每条肽链称为亚基,亚基之间又有特定的空间关系,称为蛋白质的四级结构。所以蛋白质分子有非常特定的复杂的空间结构。
通过“蛋白质结构预测”破译“第二遗传密码”,是蛋白质研究最后几个尚未揭示的奥秘之一。天津大学和中国科学院生物物理所的科学家已经做出了优秀的研究成果。他们预测,蛋白质的种类虽然成千上万,但它们的折叠类型却只有有限的650种左右。我国科学家在分子伴侣和折叠酶方面有特色的研究成果,也已经赢得了国际同行的注意。
相关概念
分子生物学的中心法则
DNA)分子的三维空间结构,阐明了生物遗传的分子基础,揭示了这个最主要的生命活动的本质,从而开创了在分子水平上认识生命现象的新学科———分子生物学。分子生物学的出现是经典生物学转变成近代生物学的里程碑。
尽管自然界的生物物种千千万万,生命现象繁杂纷飞,在分子水平研究生命,使我们认识到各种生命现象的基本原理却是高度一致的!从最简单的单细胞生物到最高等的人类,它们最基本最重要的组成物质都是蛋白质和核酸。核酸是生物体遗传信息的携带者,所有生物体能世代相传,就是依靠核酸分子可以精确复制的性质。蛋白质则是生命活动的主要承担者。所有的生命活动,呼吸、运动、消化……甚至感知、思维和学习,无一例外是依靠蛋白质来完成的。
蛋白质是一种生物大分子,基本上是由20种氨基酸以肽键连接成肽链。肽键连接成肽链称为蛋白质的一级结构。不同蛋白质其肽链的长度不同,肽链中不同氨基酸的组成和排列顺序也各不相同。肽链在空间卷曲折叠成为特定的三维空间结构,包括二级结构和三级结构二个主要层次。有的蛋白质由多条肽链组成,每条肽链称为亚基,亚基之间又有特定的空间关系,称为蛋白质的四级结构。所以蛋白质分子有非常特定的复杂的空间结构。每一种蛋白质分子都有自己特有的氨基酸的组成和排列顺序,由这种氨基酸排列顺序决定它的特定的空间结构,这就是荣获诺贝尔奖的著名的Anfinsen原理。蛋白质分子只有处于它自己特定的三维空间结构情况下,才能获得它特定的生物活性;三维空间结构稍有破坏,就很可能会导致蛋白质生物活性的降低甚至丧失。
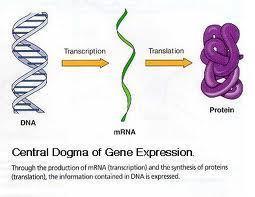
二十世纪生物学领域最重要的成就之一,是继DNA双螺旋结构的发现总结出分子生物学的中心法则,揭示生命遗传信息传递的方向和途径。近半个世纪以来对阐明中心法则有关问题有杰出贡献而获得诺贝尔奖的学者先后多达34位。分子生物学的中心法则简单表达如下:
分子生物学的中心法则中,DNA和核糖核酸(RNA)的复制、DNA转录成RNA、RNA逆转录成DNA以及以信使RNA为模板翻译成多肽链的过程和机制基本上已经阐明。但从多肽链折叠成蛋白质的过程,即所谓“新生肽的折叠”问题,是中心法则至今留下的空白,又是从“遗传信息”到“生物功能”的关键环节,有待我们在21世纪去解决。
蛋白质折叠与“折叠病”
大家都知道的疯牛病,它是由一种称为Prion的蛋白质的感染引起的,这种蛋白质也可以感染人而引起神经系统疾病。在正常机体中,Prion是正常神经活动所需要的蛋白质,而致病Prion与正常Prion的一级结构完全相同,只是空间结构不同。这一疾病的研究涉及到许多生物学的基本问题。一级结构完全相同的蛋白质为什么会有不同的空间结构,这与Anfinsen原理是否矛盾?显然这里有蛋白质的能量和稳定性问题。
从来认为蛋白结构的变化来自于序列的变化,而序列的变化来自于基因的变化,生命信息从核酸传递到蛋白。而致病Prion的信息已被诺贝尔奖获得者普鲁辛纳证明不是来自基因的变化,致病蛋白Prion导致正常蛋白Prion转变为致病的折叠状态是通过蛋白分子间的作用而感染!这种相互作用的本质和机制是什么?仅仅改变了折叠状态的分子又如何导致严重的疾病?这些问题都不能用传统的概念给予满意的解释,因此在科学界引起激烈的争论,有关研究的强度和竞争性也随之大大增强。
由于蛋白质折叠异常而造成分子聚集甚至沉淀或不能正常转运到位所引起的疾病还有老年性痴呆症、囊性纤维病变、家族性高胆固醇症、家族性淀粉样蛋白症、某些肿瘤、白内障等等。由于分子伴侣在蛋白质折叠中至关重要的作用,分子伴侣本身的突变显然会引起蛋白质折叠异常而引起折叠病。随着蛋白质折叠研究的深入,人们会发现更多疾病的真正病因和更针对性的治疗方法,设计更有效的药物。现在发现有些小分子可以穿越细胞作为配体与突变蛋白结合,从而使原已失去作战能力的突变蛋白逃逸“蛋白质质量控制系统”而“带伤作战”。这种小分子被称为“药物分子伴侣”,有希望成为治疗“折叠病”的新药。
新生肽的折叠问题或蛋白质折叠问题不仅具有重大的科学意义,除了上面提到的在医学上的应用价值外,在生物工程上具有极大的应用价值。基因工程和蛋白工程已经逐渐发展成为产值以数十亿美元计的大产业,进入21世纪后,还将会有更大的发展。但是当前经常遇到的困难,是在简单的微生物细胞内引入异体DNA后所合成的多肽链往往不能正确折叠成为有生物活性的蛋白质而形成不溶解的包含体或被降解。这一“瓶颈”问题的彻底解决有待于对新生肽链折叠更多的认识。
折叠密码研究的意义
如果说“三联密码”已被破译而实际上已成为明码,那么破译“第二遗传密码”正是“蛋白质结构预测”从理论上最直接地去解决蛋白质的折叠问题,这是蛋白质研究最后几个尚未揭示的奥秘之一。“蛋白质结构预测”属于理论方面的热力学问题。就是根据测得的蛋白质的一级序列预测由Anfinsen原理决定的特定的空间结构。蛋白质氨基酸序列,特别是编码蛋白质的核苷酸序列的测定现在几乎已经成为常规技术,从互补DNA(cDNA)序列可以根据“三联密码”推定氨基酸序列,这些在上一世纪获得重大突破的分子生物学技术,大大加速了蛋白质一级结构的测定。目前蛋白质数据库中已经存有大约17万个蛋白的一级结构,但是测定了空间结构的蛋白大约只有1.2万个,这中间有许多是很相似的同源蛋白,而真正不同的蛋白只有1000多个。随着人类基因组计划的胜利完成,解读了人类DNA的全序列,蛋白质一级结构的数据增长必定会出现爆炸的态势,而空间结构测定的速度远远滞后,因此二者之间还会形成更大的距离,这就更需要进行蛋白质结构的预测。



