氯化铝(氯和铝的化合物)

VLoG
次浏览
更新时间:2023-05-19
氯化铝
氯和铝的化合物

基本信息
| 中文名 | 氯化铝 |
| 外文名 | aluminium chloride |
| 化学式 | AlCl₃ |
| 分子量 | 133.34 |
| 熔点 | 194℃ |
展开
简介
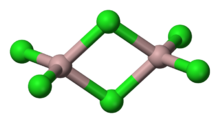
AlCl3采取“YCl3”结构,为Al立方最密堆积层状结构,而AlBr3中Al却占Br最密堆积框架的相邻四面体间隙。熔融时AlCl3生成可挥发的二聚体Al2Cl6,含有两个三中心四电子氯桥键,更高温度下Al2Cl6二聚体则离解生成平面三角形AlCl3,与BF3结构类似。
氯化铝是无色透明晶体或白色而微带浅黄色的结晶性粉末。氯化铝的蒸气或溶于非极性溶剂中或处于熔融状态时,都以共价的二聚分子形式存在。可溶于水和许多有机溶剂。水溶液呈酸性。芳烃存在下,氯化铝与铝混合可用于合成二(芳烃)金属配合物。例如,二苯铬就是通过特定金属卤化物经由Fischer-Hafner合成制备的。
氯化铝和氯化铁均为共价化合物。
物理性质
化学性质
- AlCl3(aq) + Cl(aq) ⇌ AlCl4(aq)
- AlCl3(aq) + 3 H2O → AlO2+ 3HCl + H3O
Al2O3+3C+3Cl2→2AlCl3+3CO 加热条件
2Al+3Cl2→2AlCl3 加热条件

AlCl3+4NaOH=NaAlO2+3NaCl+2H2O
氯化铝容易潮解,由于水合会放热,遇水可能会爆炸。它会部分水解,释放氯化氢或氢氯酸。
[Al(H2O)6] + H2O ⇌ [Al(OH)(H2O)5] + H3O
主要用途
由于氯化铝可与反应产物配位,因此应用在傅克反应时,它的用量必须与反应物相同,而非“催化量”。反应后的氯化铝很难回收,会产生大量的腐蚀性废料。为了达到绿色化学的要求,化学家开始使用三氟化钇或三氟化镝来替代氯化铝,减少污染。
芳烃存在下,氯化铝与铝混合可用于合成二(芳烃)金属配合物。例如,二苯铬就是通过特定金属卤化物经由Fischer-Hafner合成制备的。
低浓度的碱式氯化铝常是防汗药的成分之一,而多汗症患者在使用时浓度会高些(12%或更高)。
9.用作分析试剂、防腐剂、媒染剂。
制备方法
实验室制法
实验室用铝和盐酸在常温条件下制备(2A l+ 6HCl == 2AlCl3 + 3H2↑)。在加热条件下可以加速制备。
工业制法
工业上在常温条件下用碳氯化法制取(Al2O3 + 3C + 3Cl2 =△= 2AlCl3 + 3CO)。
无水氯化铝在石油工业中及其他某些有机合成反应中用作催化剂。
化学反应式:2Al + 3Cl2 → 2AlCl3
2.铝氧粉法:将一定粒度的工业氧化铝与石油焦按一定比例投入焙烧炉内混合均匀,由炉底通入空气进行焙烧。焙烧后的物料进入氯化炉,炉中通入氯气和氧气,铝氧粉在还原剂炭的存在下与氯反应。生成的气相产物经预冷、净化去捕集器,制得氯化铝成品。尾气经氢氧化钠或亚硫酸钠溶液吸收处理后排空;
3.熔融法:将金属铝加热熔融后通入无水氯化氢,而制得。
注意事项
无水氯化铝会和碱剧烈反应,因此需妥善处理。含结晶水的氯化铝较无此问题。
如果吸入无水氯化铝或接触眼睛和皮肤会造成刺激。
侵入途径:吸入、食入、经皮吸收。
健康危害
安全术语
S26不慎与眼睛接触后,请立即用大量清水冲洗并征求医生意见。
S45若发生事故或感不适,立即就医(可能的话,出示其标签)。
S36/37/39穿戴适当的防护服、手套和护目镜或面具。
安全措施
眼睛防护:戴化学安全防护眼镜。
防护服:穿工作服(防腐材料制作)。
手防护:戴橡皮手套。
皮肤接触:立即脱去污染的衣着,用大量流动清水彻底冲洗。
误食入:患者清醒时立即漱口,给饮牛奶或蛋清。立即就医。
灭火方法:干粉、砂土。禁止用水。
其它:工作后,淋浴更衣。单独存放被毒物污染的衣服,洗后再用。保持良好的卫生习惯。
泄漏应急处理
隔离泄漏污染区,周围设警告标志,建议应急处理人员戴自给式呼吸器,穿化学防护服。不要直接接触泄漏物,勿使泄漏物与可燃物质(木材、纸、油等)接触,用清洁的铲子收集于密闭容器中作好标记,等待处理。如果大量泄漏,最好不用水处理,在技术人员指导下清除。
急救措施
皮肤接触:立即脱去污染的衣着,用大量流动清水彻底冲洗。
眼睛接触:立即提起眼睑,用流动清水冲洗10分钟或用2%碳酸氢钠溶液冲洗。
吸入:迅速脱离现场至空气新鲜处。注意保暖,保持呼吸道通畅。必要时进行人工呼吸。就医。
食入:患者清醒时立即漱口,给饮牛奶或蛋清。立即就医。
灭火方法:干粉、砂土。禁止用水。