苯环(苯分子的结构)

VLoG
次浏览
更新时间:2023-05-23
苯环
苯分子的结构
性质
结构式
凯库勒式
德国化学家凯库勒(Kekule)与1858年提出了碳原子间能够相互连接成链的观点,到了1865年,他对苯的结构提出了一个设想,即碳链有可能头尾连接起来成环。据凯库勒本人的著作称,他因梦见一条蛇首位相接而受到启发。
凯库勒结构式是当时众多“苯环结构”中最满意的一种。它成功地解释了许多实验事实,但不能解释苯环的特殊稳定性。因为按照凯库勒的说法,苯分子中存在三个双键,虽然它们来回不停地移动,但双键始终是存在的。
凯库勒式主要存在两个问题:
(1)不能解释苯分子中既然有双键,为什么在一般情况下不能和那些能与不饱和烃发生加成反应的试剂发生类似的反应。
(2)按照凯库勒结构式,苯的邻位二元取代物应有两种异构体存在,但实验表明只有一种。
其他结构式
值得一提的是,在一本由洛希米特(近代物理学家)著,1861年出版的小册子中,前47页是368个化学结构,就在368个化学结构中,竟然有苯环结构图。而在大部分人眼里,苯环却是在4年后被凯库勒发现的。没有直接的证据表明凯库勒看过洛希米特的这本书,但凯库勒在1865年的一篇法文论文中曾提到过洛希米特的名字。这至少说明凯库勒曾看过洛希米特的一些著作。
结构理论描述
分子轨道理论
物理方法研究的结果证明苯分子是平面的正六边形结构。苯分子中的六个碳和六个氢都分布在同一平面上,相邻碳碳键之间的夹角都为120°。所以碳碳键都完全相同,键长也完全相等,为139pm,它们既不是一般的碳碳单键(154pm),也不是一般的碳碳双键(134pm)。

苯环
按照分子轨道理论,苯分子中六个碳原子都形成 杂化轨道,六个碳原子以
杂化轨道,六个碳原子以 杂化轨道形成六个碳碳σ键,又各以一个
杂化轨道形成六个碳碳σ键,又各以一个 杂化轨道和六个氢原子的s轨道形成六个碳氢
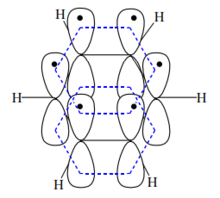
杂化轨道和六个氢原子的s轨道形成六个碳氢 键,从而形成一个正六边形,所有的碳原子和氢原子在同一平面上。碳原子保留一个和这个平面垂直的p轨道,它们彼此平行,这样碳原子的p轨道可以和相邻的碳原子的p轨道平行重叠而形成π键。
键,从而形成一个正六边形,所有的碳原子和氢原子在同一平面上。碳原子保留一个和这个平面垂直的p轨道,它们彼此平行,这样碳原子的p轨道可以和相邻的碳原子的p轨道平行重叠而形成π键。




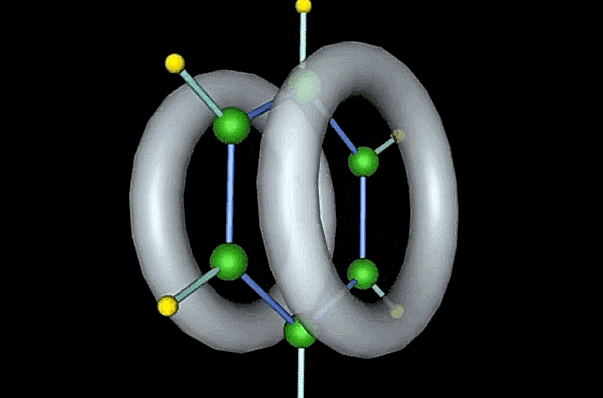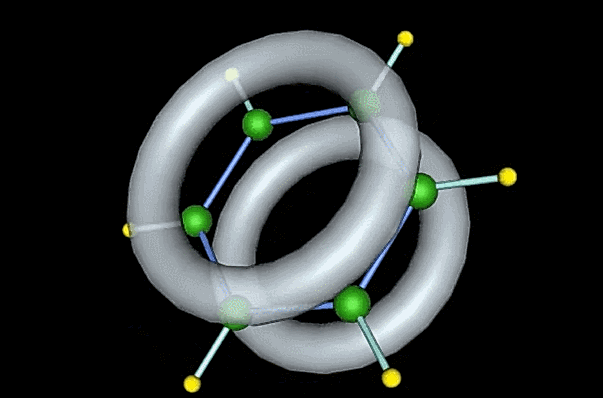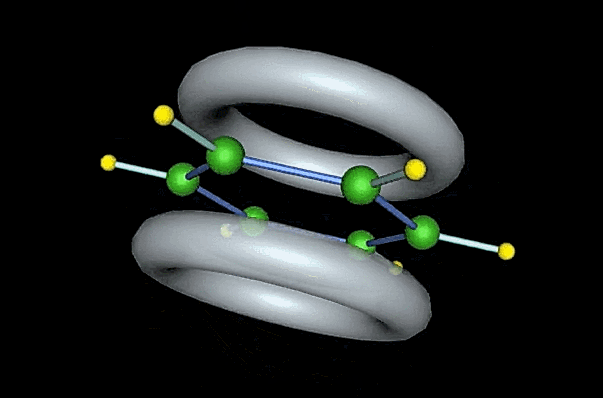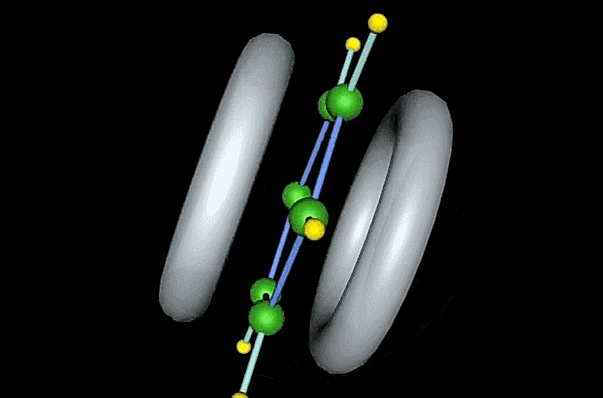
由于一个p轨道可以和左右相邻的两个碳原子的p轨道同时重叠,因此形成的分子轨道是一个包含六个碳原子在内的封闭的或称为是连续不断的共轭体系,如图所示。π轨道中的π电子能够高度离域,使π电子云完全平均化,从而能量降低,苯分子得以稳定。
根据分子轨道理论,六个p轨道通过线性组合,可组成六个分子轨道。其中三个是成键轨道以 和
和 表示,三个反键轨道以
表示,三个反键轨道以 和
和 表所示。
表所示。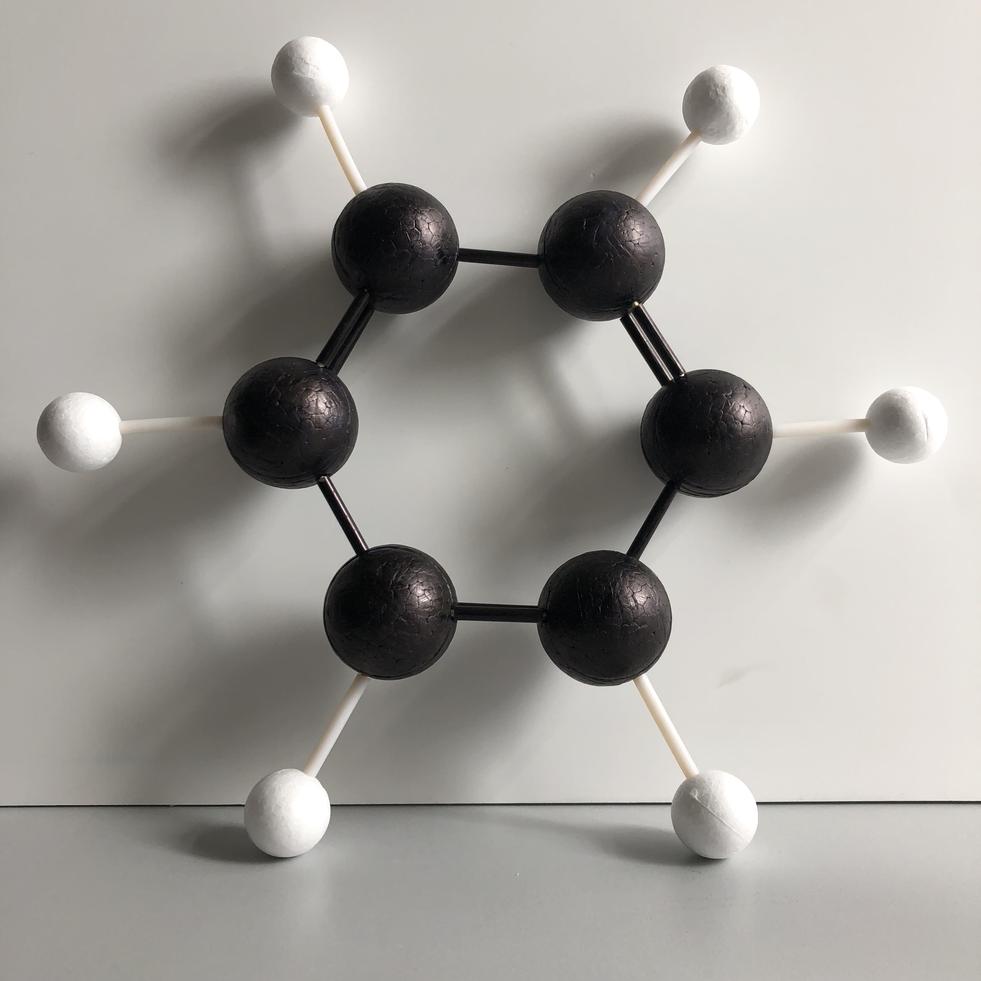





苯环
三个成键轨道中, 没有节面,能量是最低的,而
没有节面,能量是最低的,而 和
和 都有一个节面,能量相等,但比
都有一个节面,能量相等,但比 高,这两个能量相等的轨道称为简并轨道。反键轨道
高,这两个能量相等的轨道称为简并轨道。反键轨道 和
和 各有两个节面,它们的能量也彼此相等,但比成键轨道要高,
各有两个节面,它们的能量也彼此相等,但比成键轨道要高, 有三个节面,是能量最高的反键轨道。很明显,苯分子的六个π电子都在成键轨道上。这六个离域的π电子总能量,如果和它们分别处在孤立的既定域的π轨道的能量之和相比,要低得多。因此苯的结构很稳定。
有三个节面,是能量最高的反键轨道。很明显,苯分子的六个π电子都在成键轨道上。这六个离域的π电子总能量,如果和它们分别处在孤立的既定域的π轨道的能量之和相比,要低得多。因此苯的结构很稳定。







由于处于π轨道中的π电子能够高度离域,使π电子云完全平均化,因此苯分子中所有碳碳键都完全相同,键长也完全相等。
共振理论
苯分子不能圆满地只用一个结构来表示它的结构。为了解决这种难以正确表达分子真正结构的困难,有机化学中比较普遍的采用了几个共振结构式来表示结构的方法。即苯可以写出具有同样碳环而只是电子排列不同的若干个共振式,它们都有三对可以成对的π电子,并认为苯的真实结构是由这些共振结构式共振而成的共振杂化体。
(1)苯是上述共振式的共振杂化体;
(2)其中 a~b 的贡献较大,c~e 的贡献较小;
(3)共振使得碳碳键不是单键也不是双键,且六个键相同;
(4)共振使得苯的能量比 1,3,5-环己三烯能量低(共振能)。