锂(碱金属元素)

VLoG
次浏览
更新时间:2023-05-22
锂
碱金属元素

锂(英语:Lithium),是密度最小的一种金属,位于元素周期表的第二周期IA族,化学符号为Li,它的原子序数为3,原子量为6.941。常温常压下,锂是一种银白色的固体,其熔点为180.5 ℃,沸点为1342 ℃,比热容为3.58 kJ/kg·K,可溶于硝酸、液氨等溶液,可与水反应。锂的化学性质活泼,能与大部分非金属和金属发生反应。
基本信息
中文名
锂
英文名
Lithium
元素符号
Li
原子序数
3
原子质量
6.941
族
IA族
周期
第二周期
CAS编号
7439-93-2
物理性质
外观
银白色的固体
密度
0.534 g/cm³
熔点
180.5 ℃(1 atm)
沸点
1342 ℃(1 atm)
水溶性
可溶于硝酸、液氨等溶液,可与水反应
比热容
3.58 kJ/kg·K
原子性质
原子半径
152 pm
锂仅以化合物的形式存在于自然界中,在地壳中锂的含量微少且分散分布不易提取,因此把锂元素划入稀有元素之列。金属锂及其化合物的应用领域广泛,在宇航工程中、移动通信领域中、军事领域、有机合成中都起到重要的作用。
金属锂可以通过各种途径进入人体体内从而被器官组织吸收导致锂中毒,这会引起中枢神经系统中毒和肾脏衰竭。
发现历史
1817年,瑞典化学家约翰·奥古斯特·阿韦德松(Johan August Arfwedson)在透锂长石中所发现新元素锂,并将其命名为Lithium,它来源于希腊文Lithos(释义:岩石)。同时他也发现了具有工业储量的常见锂矿石如锂辉石、锂云母和磷铁锂矿。约翰指出碳酸锂在水中的溶解度很小,氢氧化锂比其它碱金属氢氧化物的溶解度也小得多,还指出锂的化合物和碱土金属的化合物很相似;十九世纪在植物和动物的机体中也发现有锂。
1818年英国的化学家威廉·托马斯·布兰德(William Thomas Brande)和汉弗莱·戴维(Humphry Davy)两人利用电解的方法从氯化锂中制得了少量的金属锂;1855年,德国人罗伯特·威廉·本生(Robert Wilhelm Bunsen)和奥古斯特斯·马提生(Augustus Matthiessen)应用电解氯化锂的方法制备了足够量的金属锂来研究它的性质。
1932年,在英国的物理学家约翰·科克罗夫特(John Cockcroft)和埃米斯特·沃尔顿(Emest walton)的开创性工作中,锂被用作金属靶,人工加速的原子粒子被用来改变锂原子核,每个锂原子核吸收一个质子成为两个气体原子核。用慢中子轰击锂-6会产生氦和氚。
分布情况
锂金属在地壳中分布分散且不易提取,主要集中于盐湖和花岗伟晶岩矿床,其中盐湖锂资源占世界锂储量的87%。锂资源主要分布在美国、中国、智利、澳大利亚、阿根廷等地。中国的锂资源主要分布在青海、西藏、四川、新疆、湖北、河南、湖南等地,青藏高原的盐湖锂资源丰富。1997年,美国地调所统计了全球已知的锂资源约为2255万吨,其中储量为587.4万吨,储量基础为1590.7万吨。
工业上四种重要的锂资源矿物是:锂辉石(spodumene)、锂云母(lepidolite)、透锂长石(petalite)以及磷铝石(amblygonite);矿泉和盐湖也是锂的重要来源,已知的天然卤水中含有浓度高达万分之几的有工业价值的锂,例如美国加利福尼亚州的西尔斯湖(SearlesLake)就是一个很大的锂源;欧洲也富含锂的地热卤水。以下列举几种典型的锂矿石。
锂辉石
目前锂辉石是提取锂化物的主要工业原料,也是锂的上述四种矿物中储量最丰富的一种,它比锂云母或透锂长石的锂含量都高,锂辉石通常多与其它矿物共生,需要富集,用浮选法富集后,可得到含锂2.8%-3.3%的精矿(6%-7%氧化锂),在美国、加拿大、巴西和扎伊尔等国家都有大量的锂辉石矿藏。
锂云母
锂云母是一种稀有的云母,没有生长良好的晶体,通常呈玫瑰红色、淡紫色,有时呈桃红色、白色,含锂约2%(4.2%-4.5%氧化锂),它仅在熔化以后才能被酸分解,在津巴布韦、西南非洲和加拿大有较多的锂云母矿,由于锂辉石对锂是一种更为合适的原料,因而锂云母不再作为制备锂化学制品的矿石而被开采了,然而这种矿物仍被用作为陶瓷工业中提供锂素的原料。
透锂长石
透锂长石通常呈灰色和暗灰色,较少呈黄色和无色,有时呈红色或绿色,密度介于2.39-2.46 g/cm³之间,它不易同酸起反应,理论上透锂长石含有2.27%的锂(3.5%-4.5%氧化锂),这种矿物在瑞典、西南非洲和南津巴布韦都有发现,透锂长石目前用作玻璃工业中锂的原料,也用作耐火材料中膨胀性低的填充剂。
理化性质
锂单质的性质
物理性质
常温常压下,锂单质是一种银白色固体,质较软,一般用刀就可切割,其断面有微黄色光泽。锂的熔点为180.5 ℃,沸点为1342 ℃,比热容为3.58 kJ/kg·K,可溶于硝酸、液氨等溶液。
锂在常温下,是非气态单质中密度最小的元素,且在碱金属元素中锂的原子半径最小,所以金属锂的晶格最为坚固。锂在一般条件下为体心立方结构,
同位素
锂元素共有10种同位素,包括2个稳定型,3个富中子型,2个质子型和3个中子无束缚共振型,10种同位素为锂-4、锂-5、锂-6、锂-7、锂-8、锂-9、锂-10、锂-11、锂-12和锂-13。在自然界中能够稳定存在的是锂-6和锂-7,其丰度分别约为7.5%和92.5%,这两个同位素均无放射性。除稳定同位素外,锂-8的半衰期最长,为839.9 ms;锂-9的半衰期也较高,为178.3 ms。剩余同位素的半衰期均低于8.6 ms,其中锂-4的半衰期是最短的。
化学性质
金属锂是非常活泼的,固态锂在合适的条件下,易与稀有气体以外的大多数非金属及许多金属发生反应,例如氧、氮、二氧化碳等气体;液态锂除了能够与上述物质发生反应,还可以与氢、碳、硅和大量其他元素发生强烈反应。
- 锂与氧气反应

- 锂与水反应

锂的新切开断面有金属光泽,但暴露在湿空气中时,断面会迅速地失去光泽并开始变黑;长时间暴露于空气中后断面则会变成白色,此时生成的化合物是氮化锂、氢氧化锂、一水合氢氧化锂,说明固态锂与氮气的反应在常温下就能进行。

- 锂与氢气反应

- 锂与酸反应


- 锂与有机化合物反应

锂化合物的性质
锂的无机化合物
- 氢化锂
氢化锂(LiH)是最稳定的碱金属氢化物,常温常压下是一种灰白色粉末状结晶,其熔点为688.7 ℃,其分解温度为850 ℃,具有较好的热稳定性。氢化锂在有机化学中是一种重要的还原剂,常用来还原某些有机化合物。
- 碳酸锂

- 氢氧化锂
氢氧化锂是最重要的锂化合物之一,有无水氢氧化锂(LiOH)和一水合氢氧化锂(LiOH·H₂O)两种。无水氢氧化锂为白色四方结晶颗粒或流动性粉末,其熔点为471.2 ℃,沸点为1626 ℃,可溶于水,微溶于乙醇。一水合氢氧化锂为白色易潮解的单晶粉末,失去结晶水转换为无水氢氧化锂。氢氧化锂被广泛地用于制备其它锂化合物的原料,例如制备锂的卤化物。

锂的有机化合物
在众多的有机锂化合物中,丁基锂是一种最主要的有机锂化合物,丁基锂(C₄H₉Li)有4种同分异构体,正丁基锂、仲丁基锂、异丁基锂和叔丁基锂,其中正丁基锂是一种澄清、无色、不挥发、稍具粘性的流动液体,在许多碳氢化合物中有无限的溶解度,用途十分广泛。
生产方法
金属锂是工业生产中十分重要的金属,被称为“二十一世纪的能源金属”。因此锂的提取工艺是十分重要的,以下提及几种重要的金属锂提取工艺和制备方法。
从锂矿物中提取锂
硫酸法
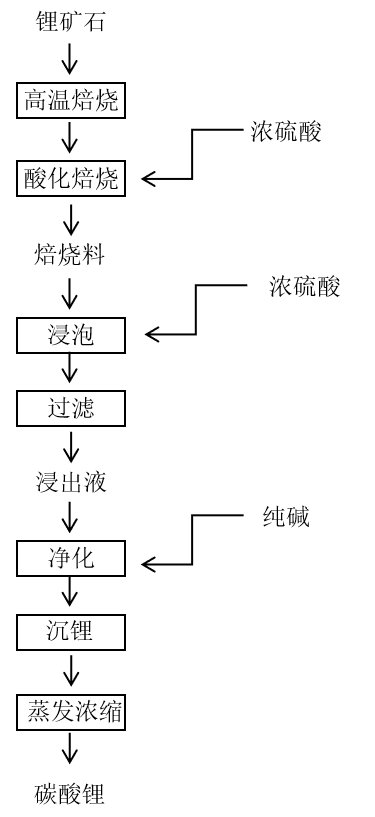
硫酸法是一种从锂矿石中提取锂的方法,具体步骤为先将锂矿石高温焙烧后进行硫酸化焙烧和浓硫酸常温浸泡,此时锂的形式转为硫酸锂(Li₂SO₄)。为除去铁、铝、钙、镁等杂质,往硫酸液中加入纯碱液。剩余溶液再经过沉锂、蒸发浓缩等步骤后可得到碳酸锂(Li₂CO₃),最后从碳酸锂中提取锂。硫酸法具有硫酸法提锂具有操作可控制、锂收率高、能耗小、其他杂质含量少(除主要杂质Si和Al外)等优点。
石灰法
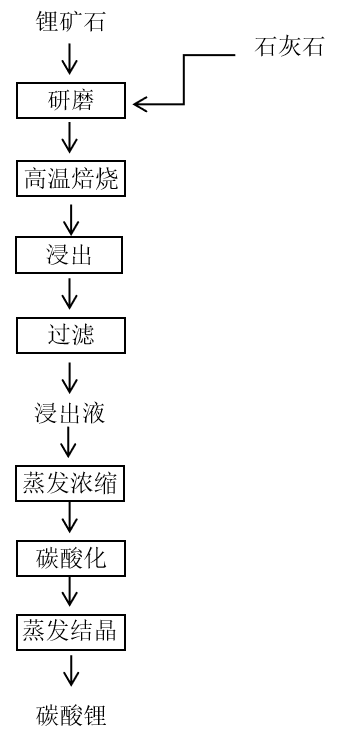
石灰法是将锂矿物与石灰石先进行充分研磨,后进行高温焙烧,使矿物中难溶的锂转为碳酸锂(Li₂CO₃)或一水合氢氧化锂(LiOH·H₂O)的方法。石灰法的主要优点是适用性很强,因为它可用来分解几乎所有的锂矿石;其缺点是要求精矿中锂的含量很高,且在浸取结块时得到的是氢氧化锂的稀溶液,因此蒸发时就需要体积庞大的设备,并且要消耗大量的热和花费大量的时间。
从天然卤水中提取锂
天然卤水(如盐湖卤水)可成为锂的工业原料,在加工过程中富集溶液中的锂再将其沉淀从而得到易分离的锂化合物。从盐湖卤水中提取锂的方法主要有吸附法、溶剂萃取法、蒸发结晶法、煅烧浸出法等。
吸附法
吸附法是利用合适的吸附剂选择吸附溶液中的锂离子,再将锂离子洗脱下来。吸附法中的吸附剂尤为关键,吸附剂可分为有机系和无机系两种。有机系吸附剂一般为有机离子交换树脂。常用的无机吸附剂主要有铝系吸附剂、锰系吸附剂等。
溶剂萃取法
溶剂萃取法是利用离子在不同溶剂中的溶解度不同,锂离子将会从溶解度较小的卤水相扩散到溶解度较大的有机相,最后浓缩得到锂。萃取法具有锂提取率高、操作安全且连续等优点,但是有可能会引入其他杂质。该方法中需选择合适的萃取剂,常用的萃取剂有含磷有机萃取剂、冠醚、胺类萃取剂、卜二酮类等。
蒸发结晶法
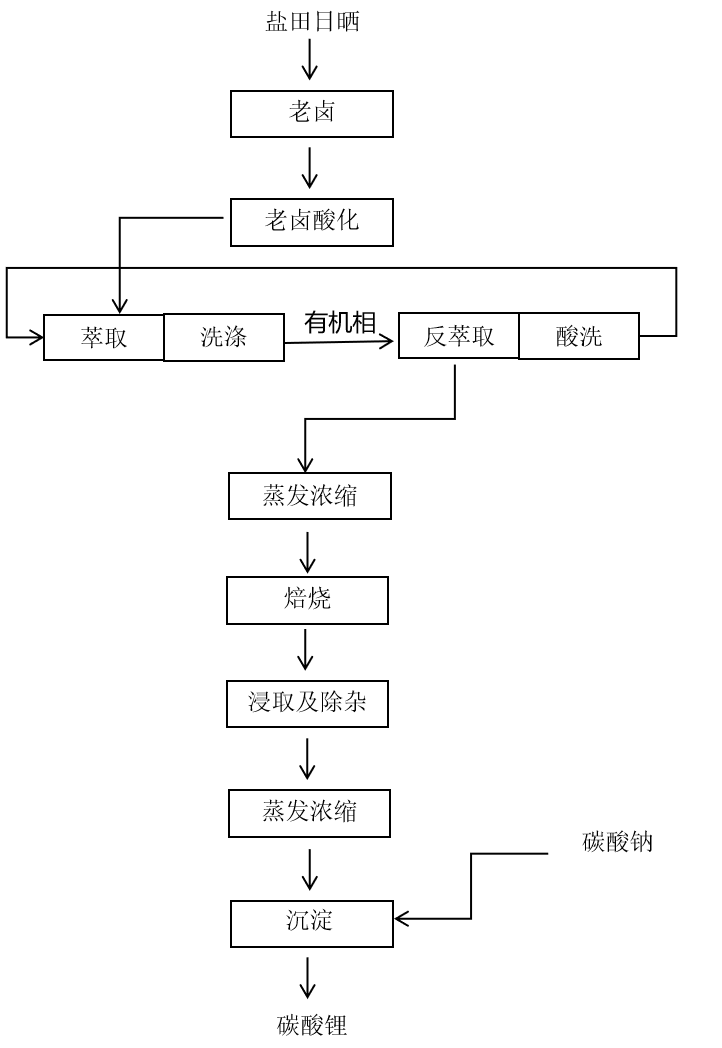
蒸发结晶法是将含碳酸锂的天然盐湖卤水通过太阳能蒸发浓缩,长时间后碳酸锂直接从卤水中析出的方法。蒸发结晶法虽然具有耗费化工原料少、工艺简单、操作容易等优点,但是该方法对天然卤水的组成有很大的要求。
煅烧浸出法
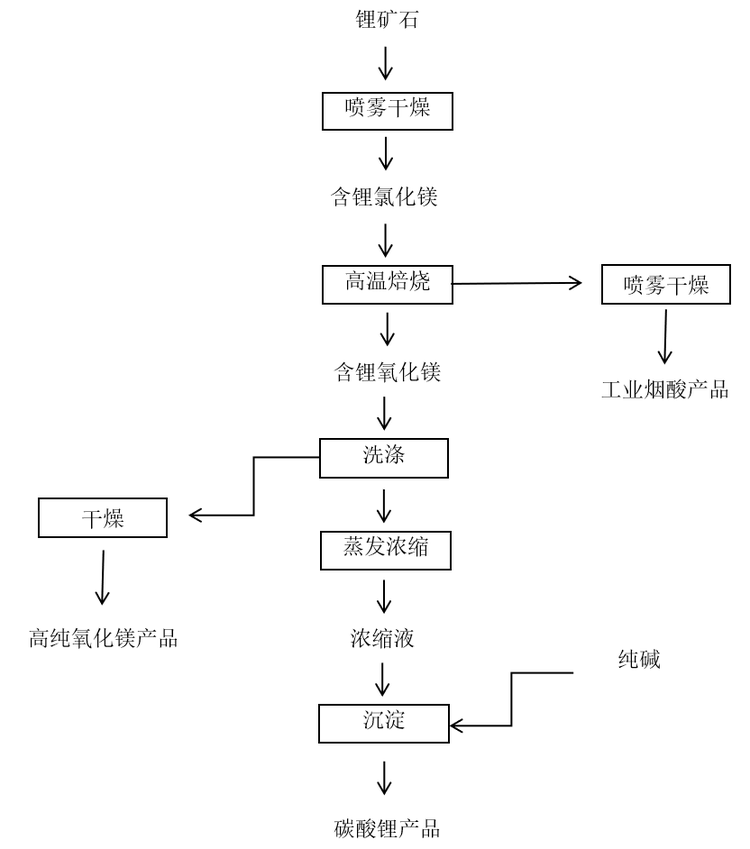
煅烧浸出法是天然卤水先通过太阳曝晒或者加热等方式蒸发浓缩,浓缩后的卤水富含锂,浓缩液再经过煅烧、浸出、固液分离等工序得到浸出液,最后往浸出液中加入石灰石、纯碱等物质,使液体中的锂转化为碳酸锂的方法。这种方法工艺流程和设备简单、锂收率高,但是耗能大且在煅烧过程中产生的氯化氢气体对设备腐蚀严重。
熔盐电解法
1855年,德国人本生(Bunsen)和马提生(Mattiessen)利用电解氯化锂(LiCl)的方法制出了大量的金属锂。现今的电解法从电解氯化锂改进为电解氯化锂-氯化钾(LiCl-KCl)混合物。熔盐电解法具体的工艺为电解熔融的锂盐与氯盐的混合物,一段时间后,阴极析出金属锂,阳极析出氯气。在电解过程中,氯化锂的比例应控制在45%-55%,此时熔融盐的熔点低、流动性能好,能节省能量。熔盐电解法也目前工业上制备金属锂的主要工艺方法,约有90%的金属锂采用熔盐电解法制备。以下为熔盐电解法制备锂的电极反应:



应用领域
随着对锂各种性能的进一步研究,金属锂及其化合物的应用范围日益扩大,以下列举一些金属锂的应用领域。
锂的应用
作还原剂和催化剂
在电池中应用
锂及其化合物能够作为关键材料生产高性能、无污染的新型绿色环保电池,包括锂原电池(一次电池)和锂蓄电池(二次电池)。此外锂还可以制作燃料电池、热电池和化学超级电容器等化学电源,而且锂离子电池的应用十分广泛,能够应用于电动车、电子汽车等产品中。
在核聚变中的应用
补充说明:核聚变可放出更多的能量,并且比裂变更清洁、安全。
在医学中的应用
锂合金的应用
锂化合物的应用
二十一世纪以来,锂化合物的用量越来越大,已经成为工业生产中十分重要的化合物。锂化合物在航空航天、核能发电、电池能源、玻璃陶瓷、石油化工、冶金、纺织、合成橡胶、润滑材料、医疗等领域均有广泛应用。接下来介绍几种常见锂化合物的应用。
碳酸锂的应用
碳酸锂(Li₂CO₃)能够有效治疗躁狂型精神病,在典型的躁狂症治疗中,它已经成为目前的首选药物,在双相和单相抑郁症治疗过程中碳酸锂也发挥着重要的作用,用碳酸盐等锂盐治疗能够明显改善并提升病人的认识功能、情感效应和记忆力。
氢化锂的应用

氧化锂的应用
氧化锂(Li₂O)具有强的助熔作用,且能够在玻璃陶瓷的生产过程中对产品的密度、热膨胀率、表面张力以及密度进行改变。
氯化锂的应用
有机锂化合物的应用
安全事宜
危险
GHS分类:
H260:与水接触会释放易燃气体,可能会自燃
H314:导致严重皮肤烧伤和眼睛损伤
图示 |  |  |
图意 | 易燃性 | 腐蚀性 |
锂粉尘能在常温下燃烧,燃烧后即成熔融物流散,并放出白色浓烟。锂加热至熔融状态时能在空气中自燃。锂单质的化学性质十分活泼,同其他碱金属一样,锂与卤素作用时反应剧烈,锂与水反应会释放出氢气,在一定条件下会发生爆炸。
生理毒性
虽然锂及其化合物能够治疗许多疾病,但是过多服用锂及其化合物会引起中枢神经系统中毒和肾脏衰竭,中毒的前驱表现是迟钝、倦怠、昏睡、肌肉抽搐、语词不清、食欲降低以及吐泻等。对于锂中毒还没有特效解毒药,主要的治疗措施是保持呼吸通畅,防止呼吸道感染。尚未发现锂中毒成瘾的情况,停止服锂药后也未观察到后遗症。
急救措施
如果不小心吸入锂金属粉末,请立即将患者转移至新鲜空气处,保持呼吸道通畅;若皮肤接触到锂金属,请立即脱去污染的衣着,并用流动清水冲洗,若接触部分仍有不适感,请立即前往医院就医;若眼睛中不小心进入了锂金属,请立即分开眼睑,用流动清水或生理盐水冲洗,冲洗结束后立即前往医院就医。若不小心误食锂金属,请立即漱口并饮用牛奶或蛋清,然后前往医院就医。
消防措施
锂的化合物在实验室中也存在着消防安全隐患,例如苯基锂溶于挥发性溶剂中所形成的浓缩溶液易起火,因此在使用苯基锂时,应当在惰性气体的保护下安全操作;正丁基锂的化学性质也非常活泼,容易燃烧,因此在贮存和运输过程中,要防撞击、防日晒雨淋,并且置于阴凉干燥处,远离火源。


