转染(真核细胞导入外源DNA的过程)

VLoG
次浏览
更新时间:2023-05-22
转染
真核细胞导入外源DNA的过程
基本信息
| 中文名 | 转染 |
| 外文名 | transfection |
| 分类 | 瞬时转染和稳定转染 |
| 学科 | 生物学 |
简介
细胞化学转染
常规转染技术可分为两大类,一类是瞬时转染,一类是稳定转染(永久转染)。前者外源DNA/RNA不整合到宿主染色体中,因此一个宿主细胞中可存在多个拷贝数,产生高水平的表达,但通常只持续几天,多用于启动子和其它调控元件的分析。一般来说,超螺旋质粒DNA转染效率较高,在转染后24-72小时内(依赖于各种不同的构建)分析结果,常常用到一些报告系统如荧光蛋白,β半乳糖苷酶等来帮助检测。后者也称稳定转染,外源DNA既可以整合到宿主染色体中,也可能作为一种游离体(episome)存在。尽管线性DNA比超螺旋DNA转入量低但整合率高。外源DNA整合到染色体中概率很小,大约1/104转染细胞能整合,通常需要通过一些选择性标记,如来氨丙基转移酶(APH;新霉素抗性基因),潮霉素B磷酸转移酶(HPH),胸苷激酶(TK)等反复筛选,得到稳定转染的同源细胞系。
转染技术的选择对转染结果影响也很大,许多转染方法需要优化DNA与转染试剂比例,细胞数量,培养及检测时间等。
分类
化学
包括:
1.DEAE-葡聚糖法
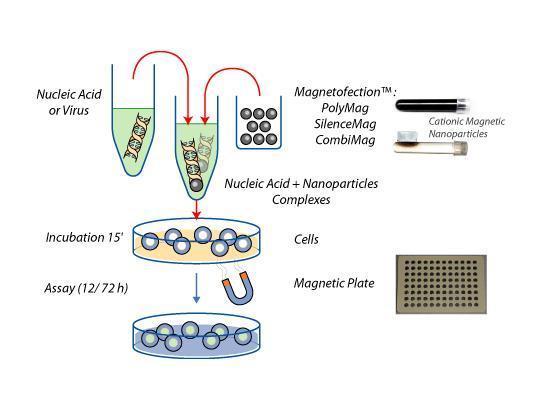
转染示意图
2.磷酸钙法
磷酸钙法是磷酸钙共沉淀转染法,因为试剂易取得,价格便宜而被广泛用于瞬时转染和稳定转染的研究,先将DNA和氯化钙混合,然后加入到PBS中慢慢形成DNA磷酸钙沉淀,最后把含有沉淀的混悬液加到培养的细胞上,通过细胞胞膜的内吞作用摄入DNA。磷酸钙似乎还通过抑制血清中和细胞内的核酸酶活性而保护外源DNA免受降解.
3.人工脂质体法。
人工脂质体法采用阳离子脂质体,具有较高的转染效率,不但可以转染其他化学方法不易转染的细胞系,而且还能转染从寡核苷酸到人工酵母染色体不同长度的DNA,以及RNA,和蛋白质。此外,脂质体体外转染同时适用于瞬时表达和稳定表达,与以往不同的是脂质体还可以介导DNA和RNA转入动物和人的体内用于基因治疗。LipoFiter 脂质体转染试剂(LipoFiterLiposomalTransfectionReagent)是一种适合于把质粒或其它形式的核酸,以及核酸蛋白复合物转染到培养的真核细胞中的高效阳离子脂质体转染试剂。它可以和带负电荷的核酸结合后形成复合物,当复合物接近细胞膜时被内吞成为内体进入细胞质,随后DNA复合物被释放进入细胞核内,至于DNA是如何穿过核膜的,其机理目前还不十分清楚。
实验
细胞转染实验
目的

基因转染示意图
原理
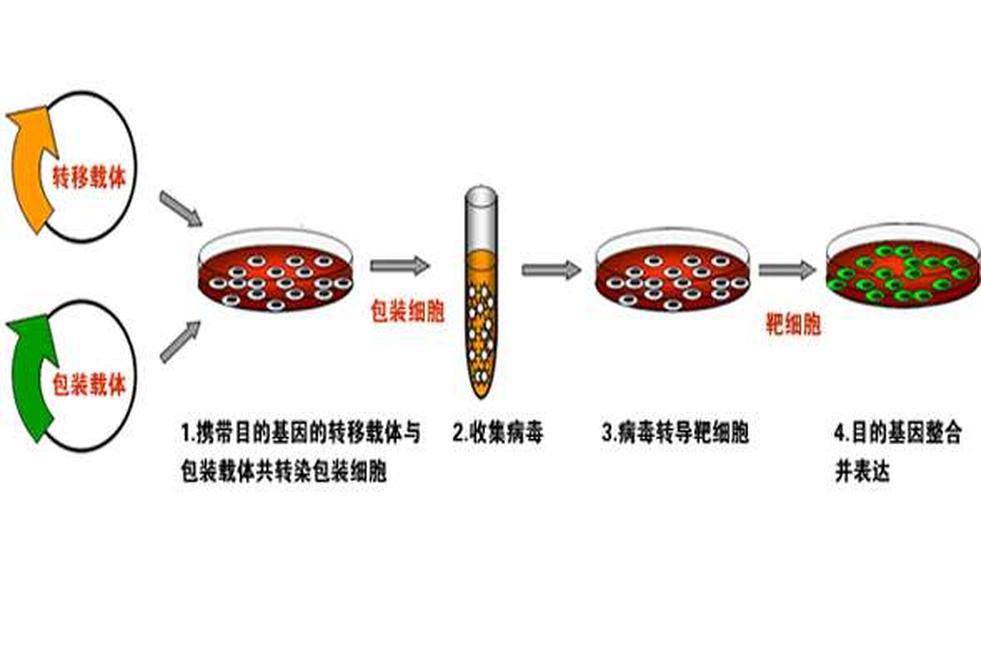
外源基因进入细胞主要有四种方法:电击法、磷酸钙法、脂质体介导法和病毒介导法。电击法是在细胞上短时间暂时性的穿孔让外源质粒进入;磷酸钙法和脂质体法是利用不同的载体物质携带质粒通过直接穿膜或者膜融合的方法使得外源基因进入细胞;病毒法是利用包装了外源基因的病毒感染细胞的方法使得其进入细胞。但是由于电击法和磷酸钙法的实验条件控制较严、难度较大;病毒法的前期准备较复杂、而且可能对于细胞有较大影响;所以现在对于很多普通细胞系,一般的瞬时转染方法多采用脂质体法。
步骤
细胞传代
(2)弃掉培养皿中的培养基,用1ml的PBS溶液洗涤两次。
(4)加入1ml的含血清培养基终止反应。
(5)用Tip头多次吹吸,使细胞完全分散开。
(6)将培养液装入离心管中,1000rpm离心5min。
(7)用培养液重悬细胞,细胞计数后选择0.8X10 个细胞加入一个35mm培养皿。
(9)将培养皿转入CO培养箱中培养,第二天转染。
1)转染试剂的准备
B.震荡后将试剂放在-20摄氏度保存,使用前还需震荡。
2)选择合适的混合比例(1:1-1:2/脂质体体积:DNA质量)来转染细胞。在一个转染管中加入合适体积的无血清培养基。加入合适质量的MyoD或者EGFP的DNA,震荡后在加入合适体积的转染试剂,再次震荡。
5)将混合液在室温放置10—15分钟。
6)吸去培养板中的培养基,用PBS或者无血清培养基清洗一次。
7)加入混合液,将细胞放回培养箱中培养一个小时。
第二次细胞传代
3)在正常条件下培养24小时后按照染色要求条件固定。
筛选
转染细胞筛选
不同的细胞株对各种抗生素有不同的敏感性,因此在筛选前要做预试验,确定抗生素对所选择细胞的最低作用浓度。
1) 提前24 小时在96 孔板或24 孔板中接种细胞8 孔,接种量以第二天长成25%单层为宜,置CO2 孵箱中37℃培养过夜。
2) 将培养液换成含抗生素的培养基,抗生素浓度按梯度递增(0, 50, 100, 200,400, 600, 800 和1000μg/ml)。
3) 培养10-14 天以绝大部分细胞死亡浓度为准,一般为400-800μg/ml,筛选稳定表达克隆时可比该浓度适当提高一个级别维持时使用筛选浓度的一半.
2.转染按前面的步骤进行。
3.转染72 小时后按1:10 的比例将转染细胞在6 孔板中传代,换为含预试验中确定的抗生素浓度的选择培养基。在6 孔板内可见单个细胞,继续培养可见单个细胞分裂繁殖形成单个抗性集落,此时可用两种方法挑选单克隆。
1) 滤纸片法:用消毒的5x5mm 滤纸片浸过胰酶,将滤纸片贴在单细胞集落上10-15 秒,取出粘附有细胞的滤纸片放于24 孔板中继续加压培养。细胞在24 孔板中长满后转入25cm 培养瓶中,长满后再转入75cm 培养瓶中培养。
4. ELISA 或Western blot 检测单克隆细胞中外源蛋白的表达情况由于不同克隆的表达水平存在差异因此可同时挑选多个克隆选择表达量最高的克隆传代并保种。
研究进展
转染技术

转染试剂
转染效率
线型PEI(LinePEI,LPEI)与其衍生物用作基因转染载体的研究比分枝状PEI(BranchedPEI,BPEI)要早一些,过去的研究认为在不考虑具体条件,LPEI/DNA转染复合物的细胞毒性较低,有利于细胞定位,因此与BPEI相比应该转染效率高一些。但最近研究表明BPEI的分枝度高有利于形成小的转染复合物,从而提高转染效率,但同时细胞毒性也增大。超高分枝的、较柔性的PEI衍生物含有额外的仲胺基和叔胺基,在染实验中发现这种PEI的毒性低,但转染效率却较高。


