细胞膜受体(细胞膜受体)

VLoG
次浏览
更新时间:2023-05-22
细胞膜受体
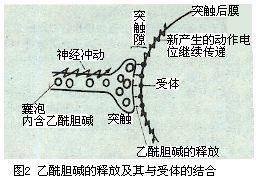
细胞膜受体(cell membrane receptor)是细胞表面的一种或一类分子,它们能识别、结合专一的生物活性物质(称配体),生成的复合物能激活和启动一系列物理化学变化,从而导致该物质的最终生物效应。细胞环境中各种因素的变化,是通过细胞膜受体的作用而影响细胞内的生理过程发生相应的变化。
基本信息
| 中文名 | 细胞膜受体 |
| 外文名 | cell membrane receptor |
| 作用 | 能识别、结合专一的生物活性物质 |
| 解释 | 细胞表面的一种或一类分子 |
定义
细胞膜受体也是镶嵌在膜脂质双分子层中的膜蛋白质。受体蛋白质一般由两个亚单位组成:裸露于细胞膜外表面的部分叫调节亚单位,即一般所说的受体,它能“识别”环境中的特异化学物质(如激素、神经递质、抗原、药物等)并与之结合;裸露于细胞内表面的部份叫催化亚单位,常见的是无活性的腺苷酸环化酶(AC)。一般将能被受体识别的环境中的特异化学物质叫信号或叫配体。配体所作用的细胞又叫那个配体的靶细胞。一般来讲,受体与配体的结合有高度特异性。当某一配体与其靶细胞膜上的特异性受体结合时,调节亚单位构型变化,随即激活膜上的AC,在Mg2+存在的条件下,AC催化细胞内一系列生物化学反应,进而引起靶细胞生理功能的改变。也有的膜受体与配体结合后并不继发细胞内一系列生化反应,而是通过改变细胞膜对离子的通透性而产生生理效应。
“受体”这个名词在19世纪末20世纪初已经开始应用,当时认为药物作用时必须与靶细胞上与之互补的分子——受体——相结合后才能发挥效应。后来受体概念的应用逐渐扩展到药物以外的其他信息分子作用于细胞的过程。
化学组成结构
由于细胞内受体含量极微,有些受体稳定性又差,因此受体的分离、纯化比较困难。迄今只有从电鳐和电鳗的电器官中分离的乙酰胆碱的烟碱胆碱能受体和从正常人胎盘中分离的胰岛素受体已经得到纯度很高、数量足够的样品,因而对它们的结构也有了较多的了解。电鳐的乙酰胆碱的烟碱胆碱能受体是由分子量为26000~64000的四种亚基组成,从电鳗分离的受体则由分子量为42000和54000二种亚基组成。电子显微镜观察的结果表明,这种受体由5~6个直径为3~4纳米的亚基构成玫瑰花结状结构,其直径约8~9纳米,中心可能是离子通道。胰岛素受体的斯托克半径约68~72埃,分子量约30~100万,它主要由3种亚基:α(分子量约135000),β(分子量约95000)和γ(分子量约45000)组成。α亚基为结合亚基,亚基之间靠—S—S—相连,亚基内部还有—S—S一结构。
数量和分布
调节
受体调节的因素和途径很复杂,在正常生理情况下受体数目受微环境影响而上升或下降,称为上升或下降调节。其中与受体结合的配体浓度对调节受体具有较重要的作用,例如,当动物或人的血液中胰岛素浓度较高时,靶细胞上的胰岛素受体浓度即下降,如果胰岛素浓度降低时,受体数目会迅速上升。受体的调节还可通过“负协同效应”来进行,即:受体-受体的相互作用会导致受体的亲和力发生变化。例如,受体与胰岛素分子的结合会促使受体与周围其他受体之间的相互作用,导致受体的亲和力下降,从而使胰岛素分子从受体上解离下来。
抗体
传递信息机理
激素受体
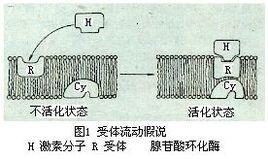
激素与受体结合后如何产生生物效应?20世纪60年代提出的第二信使假设认为,作为第一信使的激素分子与细胞膜受体结合后并不进入细胞。结合激素的受体能使位于膜上的腺苷酸环化酶活化,从而使ATP转成环(化)腺苷酸(cAMP),后者称为第二信使,它能引发细胞内一系列生化反应而产生最终生物效应。例如,肾上腺素在肾上腺髓质分泌后通过血液输送至肝细胞产生效应。它们与肝细胞表面受体相结合后能使膜上腺苷酸环化酶活化催化ATP形成cAMP,后者使蛋白激酶等一系列酶蛋白相继活化,最终使糖原分解成葡萄糖,从而使血糖浓度升高。其他一些激素,例如,促肾上腺皮质激素(ACTH),促卵泡激素(FSH),胰高血糖素和儿茶酚胺激素等在作用时也都是分别与它们的靶细胞受体相结合,导致腺苷酸环化酶的激活产生cAMP。这些激素在细胞膜上具有各自专一的受体,但腺苷酸环化酶却是共用的。待激素分子与膜受体相结合形成复合体后,它们在膜上进行侧向移动,一旦与腺苷酸环化酶相遇偶联才能导致后者的构象变化而被激活。一旦激素稀释或解离,受体和腺苷酸环化酶便又经移动而回到非偶联状态。这称为“受体流动假说”(图1)。
有些受体,如α类肾上腺素能受体与激素结合后细胞内不是cAMP而是Ca2+的浓度有明显增加,这可能是由于膜上Ca2+通道开启,使细胞外Ca2+进入细胞引起的。Ca2+能与钙调蛋白结合并引起一系列反应,因而有人认为Ca2+也是一种第二信使。
近年来,发现有些激素,如胰岛素,与细胞膜受体结合后并不仅仅停留在表面,形成的胰岛素-受体复合物可通过内吞方式进入细胞内部(见内吞与外排),继而这些复合物再与溶酶体融合或与其他细胞器膜相结合而产生生物效应。
利用高纯度的胰岛素研究表明,胰岛素与受体的α亚基结合后可使受体本身固有的某种蛋白激酶活化,使受体分子本身,主要是β亚基发生磷酸化作用,这称为自身磷酸化作用,它继而又引起一连串的磷酸化反应,这可能是胰岛素产生生物效应过程中一个十分重要的环节。
毒素受体
现在发现很多毒素也是通过与细胞膜上的受体相结合后才产生效应的。如霍乱毒素是霍乱弧菌产生的外毒素,分子量为84000,由A、B二种亚单位组成。A亚单位有两条肽链A1和A2,由一对二硫键联接。亚单位B与细胞膜上的受体相结合。亚单位A1则具有激活膜上腺苷酸环化酶的作用。
霍乱毒素的受体是一种神经节苷脂,毒素与它结合后可能会发生一系列反应,如首先引发受体的构象变化,接着亚单位A1在激活腺苷酸环化酶的过程中将烟酰胺腺嘌呤二核苷酸(NAD)中的腺二磷核糖转移到细胞膜中的一种蛋白质上。在正常情况下,鸟三磷通过与这种蛋白质相结合使腺苷酸环化酶激活,待鸟三磷被鸟三磷酶水解,激活作用即停止。但是如果鸟三磷结合在含有腺二磷核糖的蛋白质上就不易被水解,因而延长了腺苷酸环化酶作用的时间,产生的生物效应的持续时间也比较长。
霍乱毒素的作用与激素有几点不同:①激素的启动时间很短,霍乱毒素常常要延迟1~3刻钟后才开始;②激素去除后,效应很快消失,而霍乱毒素在去除后生物效应还可持续几小时到几天;③一种激素的受体只在少数几种细胞中存在,而霍乱毒素的受体在很多细胞膜上都有分布。
凝集素受体
凝集素是从各种植物或低等动物组织中分离而得到的一类特殊蛋白质,能与动植物细胞表面的受体发生特异性结合产生一系列的生理效应。它们通过与细胞表面寡糖结构决定簇的交互作用导致细胞发生凝集,因而又称凝集素。最早发现它们能诱导红细胞发生凝集而用于临床血型分类,故又有植物血凝素之称。目前已报道的凝集素多达500种。
与凝集素特异结合的受体位于细胞表面,具有复杂的寡糖链结构,它们拥有特殊的联结、侧链及多肽附着物。在这些寡糖链间还存在非共价键(如氢键)的相互作用。凝集素与受体寡糖链的结合部位以往都认为是末端的糖残基,现在证明还能与多糖核心部位相结合。
不同的凝集素可以各有专一的受体,但也可以具有共同的受体。总的来讲,凝集素受体的专一性比抗原-抗体的专一性要差。
凝集素使细胞凝集是由于一个凝集分子能与细胞表面两个或两个以上的结合点结合后所引起的。