氯化银(银的氯化物)

VLoG
次浏览
更新时间:2023-05-23
氯化银
银的氯化物

氯化银
氯化银( Silver chloride)是一种重要的无机化合物,银的常见氯化物之一,化学式为AgCl,相对分子质量为143.32。它的外观呈现为白色粉末状晶体,无味,难溶于水,微溶于氨水和硝酸中。氯化银的密度和熔点较高,分别为5.56g/cm³和455°C,折光率为2.071。
基本信息
中文名
氯化银
英文名
Silver chloride
别名
氯银
化学式
AgCl
相对分子质量
143.32
CAS编号
7783-90-6
外观
白色粉末
熔点
455摄氏度
密度
5.56 g/cm³
水溶性
难溶于水
沸点
1550摄氏度
EINECS号
232-033-3

氯化银
理化性质
物理性质

在紫外线下分解的氯化银
氯化银外观上呈现为无味的白色结晶状粉末,相对分子质量143.32,在紫外线照射下会由白色逐渐变为紫黑色。氯化银的密度为5.56 g/cm³,熔点为455°C,沸点为1550℃,属于较高密度及熔点的银化合物。但其热导率为0.009W/(cm·K),属于较低水平。氯化银的摩尔质量为143.32 g/mol,因其在水中溶解度较低,在室温下仅为1.93mg/L,故可称其不溶或难溶于水,氯化银同时不溶于乙醇,微溶于氨,但极易溶于盐酸等含氯离子的溶液。
氯化银具有较好的导电性,故可被用于制作电极。同时具有良好的光敏性,对光敏感,常被应用于摄影领域。
化学性质
氯化银,银离子与氯离子反应生成的的无机化合物,化学式为AgCl。在室温下,氯化银的化学性质较为稳定,但暴露在潮湿环境中则会逐渐分解,生成氢氯酸和亚氯酸银,紫外线照射和高温也可使氯化银发生分解反应,分解为银单质与氯气。

氯化银在氨中的溶解度
在化学反应方面,氯化银可与氨水反应生成淡黄色的沉淀,还具有氧化性,可与有机物和还原剂发生反应,可被还原剂如氢气、氨气等还原为银。和其他卤化银反应可形成双卤化银,如氯化亚银、溴化亚银等。同时,氯化银也可以和碱性金属进行反应形成氯化物,如氯化钠、氯化钾等。
因其大多数反应都会生成有毒的氯气,因此在进行操作时应注意做好防护工作,避免吸入。氯化银本身也属于有毒化学物品,虽然毒性不强但仍应做好防护。
常见化学反应
氯化银的日光分解
氯化银在受到紫外线照射时会发生分解反应,外观上从白色粉末转变为紫黑色粉末,这一反应在光学领域有着广泛的应用,化学反应式为:

氯化银与氢气

氯化银与硫酸钠
氯化银在加热条件下也可以和硫酸钠发生反应,将氯化银中的银离子还原沉淀下去,反应同时还会产生氯化钠和二氧化硫、氧气,这一反应可用于还原含氯化银溶液中的银单质,化学反应为:

氯化银与碳酸钠



分子结构

氯化银晶体结构
氯化银是离子晶体,其晶格结构为面心立方最密堆积晶系,空间群为Fm-3m。在氯化银晶体中,银离子(Ag+)和氯离子(Cl-)交替排列呈八面体构型排列,每个银离子周围被六个氯离子包围,而每个氯离子周围也被六个银离子包围,这一特性使得氯化银具有高密度的物理性质。

氯化银的离子结构
氯化银晶体中,银离子和氯离子之间的距离为0.276 nm,晶体的晶胞参数为a=0.5629nm,晶格常数为5.916 Å。由于银离子和氯离子之间的电性差异,氯化银具有很高的离子键能,因此其具有高熔点和高热稳定性。同时,由于其晶格结构的稳定性,氯化银在水中的溶解度极低,可近似看做不溶,但氯化银可以在氨水中形成络合物,使其溶解度增加。
制备方法
盐酸法
氯化铵法
氯化铵还原法制备氯化银的优点是反应条件温和,易于控制,产物纯度高,适用于生产高纯度氯化银。因此,在电子、光学、医学等领域中,氯化银的制备往往采用氯化铵还原法。其化学反应式为:AgNO3+NH4Cl=AgCl↓+NH4NO3
氯化钠法
氯化钠法可用于生产纳米级别的氯化银晶体,具有操作简单、反应迅速、产量高、反应选择性好、处理方便等特点,多被应用于科研领域。将氯化钠溶液滴加至硝酸银溶液中,同时配合使用磁力搅拌器进行搅拌。将所有氯化钠溶液全部滴入硝酸银溶液后继续搅拌反应,将所得沉淀过滤洗涤、烘干提纯,即可得到纳米级别的氯化银晶体。而氯化钠法的大规模生产则需将搅拌时间和静置时间分别提高到两小时和八小时,所有步骤皆须在暗室环境下进行。
应用领域
氯化银具有良好的光学敏感度,因此在生产生活中常被应用于摄影胶片、照片软板的感光剂、光学测量。同时,由于氯化银难溶于水,在实验室中常被用来测定样品的含银量。同时,在电子领域,氯化银还可被用来制作银-氯化银-参比电极和氯化银电池。在医学领域,也可被用于生产抗菌材料,如抗菌纸和抗菌敷料。同时也可以被制作为医用电极,测量人体的生物电信号。
光学摄影领域
由于氯化银具有较高的折射率和透过率,折光率达到了0.271。且红外线对氯化银玻璃具有良好的穿透性,因此在生产生活中氯化银可被用于制造光学透镜。与此同时,氯化银的见光变色性还被应用于制作变色玻璃,这种玻璃在强光的照射下自动变为暗色,而在弱光环境下则恢复原色,但由于生产成本较高,多用于轿车玻璃和特殊避光建筑物。

氯化银照片
另外,氯化银还是黑白摄影胶片的重要成分之一。由于氯化银具有良好的光学敏感度,当暴露于光线下时,胶卷或胶片上的氯化银由于受到紫外线的照射发生见光分解反应,从而产生黑色的银粒子,这些粒子就构成了黑白照片的图像。因此,氯化银在摄影领域中被制作成乳状的感光剂,广泛使用于胶卷和胶片之中。此外,氯化银还可用作红外光学元件。
电子科技领域
由于氯化银本身具有电导性和光导型,因此早在1880年便被化学家沃伦德拉鲁制作成了海水电池,并在第二次世界大战中被大规模生产,以作为鱼雷、船舶夜航浮标、渔业夜光浮标、无线电观测器等军用和民用产品的动力来源,具有在中性电解液中熔融不分解、便于轧制等优异性能。而后在爆破领域又出现了由氯化银制作而成的干电池,同样具有优异的电学性能,储存十二个月后电池性能依旧没有下降。

氯化银电极
不仅如此,氯化银在电极领域也有广泛的应用,由氯化银和银制作成的银-氯化银-参比电极由于结构简单、体积小,被广泛应用于科研领域中,作为其他电极的内参比电极,这种电极由电解提炼的高纯银单质经过表面镀上一层氯化银,而后于含有氯离子的盐溶液中制成。同时,由于氯化银电极的半电池电动势能稳定性远远优于普通电池,因此其极化电位很小,在生物电位的测量中极为有用。
冶金化工领域
氯化银在冶金领域有多种应用。如作为提取黄金和其他贵金属的试剂。氯化银可以与金和铂等贵金属形成难溶的氯化物沉淀,在提取黄金和其他贵金属的过程中起到重要作用。而在提取银的过程中,则多采用将含银矿石与氯化钠混合加热,而后利用氯化钠在高温下的分解反应生成氯气,从而含银矿石反应生成氯化银,随后通过加入金属铜还原氯化银,即可得到纯净的银金属。此外,氯化银在实验室中还可用于测定金和银的含量。
另外,氯化银还可以用于冶金催化剂的制备,例如催化剂氯化银-氯化铜可以用于裂解丙烷制取乙烯。或是用于测定其他氯化物的氯含量,即向溶液中加入硝酸银,而后利用氯化银的沉淀吸附性进行测定,这种方法被称为沉淀滴定法。
医疗医药领域
氯化银在医学上可被应用于制作抗菌杀菌材料,如将氯化银和硝酸银混合制作成杀菌纸敷料,可敷在伤口处,能够有效的杀灭革兰氏阳性菌和阴性菌。也可将纳米级别的氯化银微粒添加至纱布和其他敷料之中,制作成可以有效促进伤口愈合的新型医用敷料。
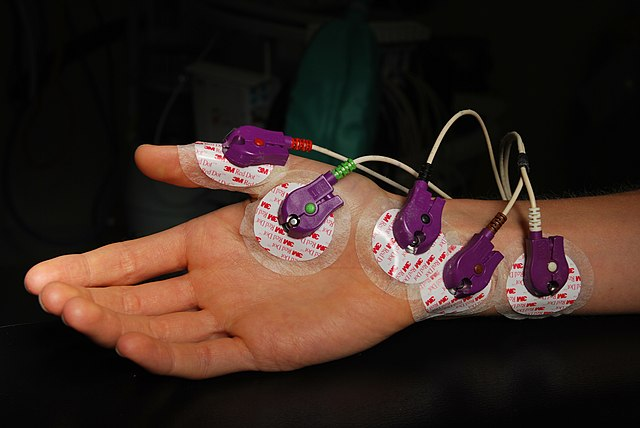
氯化银电极片
鉴别方法
安全事宜
健康危害
氯化银对眼睛、皮肤、呼吸道和消化道具有刺激性,接触或摄入氯化银接会导致恶心、呕吐、腹泻、腹痛、僵硬、抽搐和休克等症状,还可能引起紫绀(由于血液缺氧导致皮肤变蓝)。慢性吸入或摄入氯化银可引起银中毒,由于银离子的长期积累会导致眼睛、皮肤、粘膜和内脏器官出现永久性的蓝灰色变色。
运输与储存
氯化银是一种具有毒性和易燃性的化学品,危险化学品运输标号为 UN-3086。储存和运输时需要注意安全,对于储存,由于氯化银见光即可分解产生氯气,且可以与多种化学物质发生反应,故将储存时应该将氯化银存放在干燥、通风良好、避免阳光直射的地方。并且应该与其他化学品分开存放,避免发生意外事故。
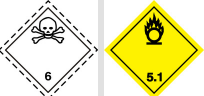
氯化银危险品运输编号
运输时,应采取密闭、遮光的容器,如遮光玻璃和塑料容器。并且应该在包装上标明有毒和易燃标志,以提醒运输工作人员注意安全。在运输过程中,为避免氯化银在高温下发生分解,应将温度控制在室温以下。出现问题时应及时报告有关单位,并依据有毒化学品、易燃化学品泄漏处置标准进行处理。


