钛(过渡金属)

VLoG
次浏览
更新时间:2023-05-23
钛
过渡金属

钛(英文:Titanium)是一种化学元素,元素符号为Ti,原子序数为22,位于第四周期的IVB族。钛属于过渡金属,在常温常压下是深灰色有金属光泽的固体,熔点为1668 ℃,沸点为3287 ℃,在20 ℃时密度为4.506 g/cm³,不溶于水,可溶于稀硫酸。干燥的钛粉在空气中易被火花、静电等点燃,发生剧烈燃烧或爆炸。
基本信息
中文名
钛
英文名
Titanium
拼音
tài
元素符号
Ti
原子序数
22
原子质量
47.867
元素类别
过渡金属
族
IVB族
周期
第四周期
区
d区
电子排布
1s² 2s² 2p⁶ 3s² 3p⁶ 3d² 4s²
([Ar]3d² 4s²)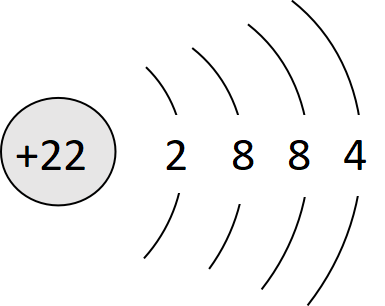
原子核外电子排布图

CAS编号
7440-32-6
物理性质
外观
深灰色有光泽金属的固体(常温常压)
密度
4.506 g/cm³(20 ℃)
熔点
1668 ℃(1 atm)
沸点
3287 ℃(1 atm)
临界点
临界温度:4350 ℃
临界压力:113×10³ KPa
熔化热
15.45 kJ/mol
汽化热
9.83×10⁶ J/kg
比热容
15.45 kJ/mol
自燃温度
固体:1200 ℃
粉末:250 ℃
原子性质
电负性
1.54(鲍林标度)
原子半径
0.1468 nm
纯净钛密度小,约为铁的一半,其拥有良好的韧性、耐热性、可塑性、抗腐蚀性和较高的机械强度。钛在常温或低温下的空气和水中都是十分稳定,因为其表面有一层致密氧化膜。钛在高温下是一种非常活泼的金属,能与HCl、H₂SO₄、HNO₃等酸类化合物反应,也能与非金属氧、氯、氢、碳等元素反应。较为特殊的是,钛可以在氮气中燃烧。
钛在地壳中元素含量排第十名,虽含量较丰富,但是其分布极为分散而且冶炼难度大,所以钛被长期认为是一种稀有金属。钛可以通过金属热还原法、钙热还原法、电化学还原法等方法制备。钛及其钛合金广泛应用于航天航空、医学、化工、军事等领域。
发现历史
1791年,英国牧师及矿物学家威廉·格雷戈尔(William Gregor)找到一种具有磁性的黑沙(即黑磁铁矿),并对该黑磁矿进行分析,发现其中包括磁铁矿、氧化硅以及棕红色矿渣,由于受当时科技的限制,并未对棕红色矿渣进一步研究,但他很确信矿物中存在一种具有奇异性质的新金属元素,该金属元素即为钛。1795年,德国化学家马丁·海因里希·克拉普罗斯(Martin Heinrich Klaproth)在研究匈牙利的金红石成分时,再次发现了格雷戈尔所述的棕红色矿渣,确信这是同一种金属元素的氧化物,并对这种元素命名为Titanium。19世纪初,瑞典科学家永斯·雅各布·贝采利乌斯(Jöns Jacob Berzelius)首次制取出钛单质。19世纪40年代,法国化学家查里·弗雷德里克·日拉尔(Charles Frederic Gerhardt)以氧原子量为16的基准,测定了钛的原子量为50。1869年,俄国化学家德米特里·伊万诺维奇·门捷列夫(Mendelé Dmitri Ivanovich)发布了第一版元素周期表,其中包括了Ti元素。格雷戈尔和马丁·海因里希·克拉普罗斯在矿物质中发现的均为粉末状Ti氧化物—TiO₂,首次冶金得到Ti单质的是美国化学家马修·亨特(Matthew A. Hunter)。1910年,马修·亨特在前人的方法上改进,将金属Na和TiCl₄一同放到耐高压的钢瓶中,加热至高温,一段时间后冷却并洗去NaCl,最终得到纯度高达99.9%Ti单质,这种方法被称为Hunter法。1923年,英国化学家弗朗西斯·威廉·阿斯顿(Francis William Aston)利用光谱仪对钛原子质量测定时发现了⁴⁸Ti。1935年,阿斯顿发表的文章《The Isotopic Constitution and Atomic Weights of Hafnium, Thorium, Rhodium, Titanium, Zirconium, Calcium, Gallium, Silver, Carbon, Nickel, Cadmium, Iron and Indium》(译文:铪、钍、铑、钛、锆、钙、镓、银、碳、镍、镉、铁和铟的同位素组成和原子量)中宣布,发现了钛的同位素⁴⁶Ti、⁴⁷Ti、⁴⁹T、⁵ºTi。1940年,卢森堡科学家威廉·贾斯汀·克劳尔(William Justin Kroll)利用金属Mg还原TiCl₄得到可锻炼的金属Ti,该方法称为Kroll法。1948年,美国开始利用Kroll技术冶炼金属Ti,年产率达2 t。随着科技的发展,冶钛工艺不断地取得新的突破,但现工业生产Ti仍多以Kroll法和改进后的Hunter法为主。
分布情况
钛在自然界中分布很广,在地壳中丰度约为0.56%,在元素含量中排第十位,在金属元素含量排第七位,仅次于铝、铁、钙、钠、钾、镁含量。钛的含量不算少,但是其分布极为分散而且冶炼难度大,所以钛被长期认为是一种稀有金属。钛资源主要为金红石、钛铁矿、钒钛磁铁矿、钙钛矿等,主要分布在中国、澳大利亚、南非、印度、美国、加拿大、挪威、乌克兰等国家,其中中国的钛资源储量居世界之首。
化学结构
原子核外电子的排布需遵循三个原则:(1)泡利不相容原理;(2)能量最低原理;(3)洪特规则[12]。钛的原子序数为22,核外电子数共有22个,其电子构型为1s²2s²2p⁶3s²3p⁶3d²4s²([Ar]3d²4s²)。
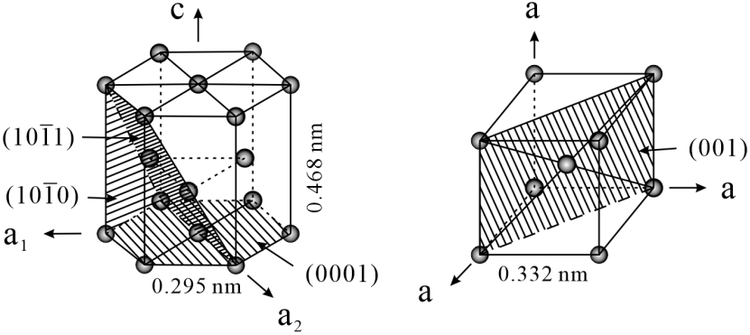
钛单质有两种同素异构体:α-Ti和β-Ti。α-Ti是六方晶系,原子堆积方式为六方密堆积,原子空间利用率高达74%。β-Ti为立方晶格,原子堆积方式为体心立方密堆积,原子空间利用率为68%。当钛晶体中出现少量的缺陷时会影响晶体的性质,如机械强度、导电性等。
理化性质
物理性质
单质钛在常温常压下是深灰色有金属光泽的固体,熔点为1668 ℃,沸点为3287 ℃,在20 ℃时密度为4.506 g/cm³,不溶于水,可溶于稀硫酸。纯净钛是一种无磁性金属,其密度小,拥有良好的韧性、耐热性和抗腐蚀性。钛的导热性能和导电性能都较差,导热系数和导电性都与不锈钢差不多。钛具有超导性,超导临界温度为0.38-0.4 K。
钛具有可塑性,高纯钛的延伸率为50%-60%,断面收缩率可达70%-80%。若钛中掺杂着杂质时,对它的力学性质影响很大。如钛中存在氧、氮、碳等杂质时,其硬度提高,塑性降低。钛是一种记忆金属,可以在较低的温度中被随意制成一种形状,然后加温后又能变回原来的形状,具有记忆性。
同位素
自1923年英国化学家阿斯顿发现钛同位素⁴⁸Ti之后,科学家陆续续续发现了25个钛同位素,其中包括5个天然稳定同位素(⁴⁶Ti、⁴⁷Ti、⁴⁸Ti、⁴9Ti、⁵ºTi)、7个富含质子的钛同位素和13个富含中子的钛同位素。⁴⁶Ti、⁴⁷Ti、⁴⁸Ti、⁴⁹Ti、⁵ºTi的相对丰度分别为8.25%、7.44%、73.72%、5.41%和5.18%。
表1:钛同位素的半衰期
同位素 | 中子数 | 半衰期 | 相对丰度 |
³⁸Ti | 16 | < 120 ns | / |
³⁹Ti | 17 | 28.5 ms | / |
⁴ºTi | 18 | 52.4 ms | / |
⁴¹Ti | 19 | 81.9 ms | / |
⁴²Ti | 20 | 208.65 ms | / |
⁴³Ti | 21 | 509 ms | / |
⁴²Ti | 22 | 59.1 y | / |
⁴⁵Ti | 23 | 184.8 min | / |
⁴⁶Ti | 24 | 稳定 | 8.25% |
⁴⁷Ti | 25 | 稳定 | 7.44% |
⁴⁸Ti | 26 | 稳定 | 73.72% |
⁴⁹Ti | 27 | 稳定 | 5.41% |
⁵ºTi | 28 | 稳定 | 5.18% |
⁵¹Ti | 29 | 5.76 min | / |
⁵²Ti | 30 | 1.7 min | / |
⁵³Ti | 31 | 32.7 s | / |
⁵⁴Ti | 32 | 2.1 s | / |
⁵⁵Ti | 33 | 1.3 s | |
⁵⁶Ti | 34 | 0.2 s | / |
⁵⁷Ti | 35 | 98 ms | / |
⁵⁸Ti | 36 | 58 ms | / |
⁵⁹Ti | 37 | 28.5 ms | / |
⁶ºTi | 38 | 22 ms | / |
⁶¹Ti | 39 | 15 ms | / |
⁶²Ti | 40 | > 620 ns | / |
⁶³Ti | 41 | > 360 ns | / |
化学性质
①与卤素和氧的反应




钛与氧的反应受多种因素的影响。当钛成粉末状时,在常温下的空气中,静电、摩擦等作用下就会发生剧烈燃烧或爆炸。气氛不同也会影响钛的燃烧温度,在空气中,钛需在1200-1300 ℃下才能发生剧烈反应;在纯氧气氛中,燃烧温度降为500-600 ℃。

钛能与氢形成Ti-H固溶体和TiH、TiH₂化合物。固溶体是指溶质原子溶入溶剂晶格中而仍保持溶剂类型的合金相。钛能在高温下与碳族单质发生反应,如和碳生成TiC,和硅反应生成TiSi、TiSi₂、Ti₅Si₃。钛也能与氮族单质反应,如氮、磷。高温下,钛是为数不多能在氮气中燃烧的金属,能生成氮化物(Ti₃N、TiN等)和Ti-N固溶体。与磷单质反应产物与温度有关,在450-800 ℃之间生成Ti₂P,高于850 ℃时生成TiP。
③与锆、钒族、铬族、钪元素生成无限固溶体。
无限固溶体即为连续的固溶体,当两种金属具有相同的晶体结构、相近的原子半径、相近的电负性时,由于电负性相近不易形成化合物,反而会导致溶质原子取代了溶剂原子的位置生成固溶体。钛固溶体也可分为α相固溶体和β相固溶体。
④与HF、HCl、H₂SO₄、HNO₃等酸发生反应。
HF、HCl气体能在加热或高温的条件下与钛反应。


HF溶剂极易与钛反应,即使是浓度为1%的HF溶液也能剧烈反应。浓度高于20%HCl溶液在室温下即可与钛反应生成紫红色的TiCl₃。




钛与加热的浓H₂SO₄反应可生成SO₂。



⑤与KOH等碱的反应



⑥与NH₃、H₂O的反应


钛的化合物
由于钛的价态较多,其氧化物种类也较多,有TiO₂、Ti₂O₃、TiO、Ti₂O₂、Ti₃O₅。TiO₂是一种白色的化学性质稳定的弱两性氧化物。其存在三种同素异形体,金红石型、锐钛型和板钛型,其中金红石型是最稳定的。TiO₂也可称为“钛白”,可作白色颜料,在生活中广泛应用。TiO₂可以通过电化学还原法制备钛单质。Ti₂O₃是一种紫黑色粉末,属于弱碱性氧化物。TiO是一种具有金属光泽的金黄色物质,属于碱性氧化物。TiO很容易被氧化,是一种较强的还原剂Ti₃O₅有α、β、γ等多种晶型,其具有良好的导电性。
钛的四卤化物有TiF₄、TiCl₄、TiBr₄、TiI₄。除了TiF₄是离子化合物,其余均为共价化合物。TiCl₄是钛的重要化合物之一,可以与醚、酮、胺等形成化合物。TiCl₄也是目前用以制备单质钛最常用的原料之一,其可以通过Hunter法、Kroll法、熔融盐电解法等方法制备单质钛。钛的氯化物还有TiCl₃,可以由TiCl₄与Ti反应制备。
制备方法
金属热还原法
卤化钛还原法主要是利用还原剂还原TiCl₄,还原剂可选择Na、Mg、Li等金属。卤化钛还原法还可分为Hunter法、Kroll法等。
①Hunter法
Hunter法是最早冶炼钛金属的方法。Hunter法采用的是二段还原,在高温下先利用金属Na还原TiCl₄生成TiCl₂,TiCl₂溶解在熔融的NaCl然后再继续用金属Na还原为钛单质。这种方法虽然还原速度快、操作简单,但是生成的钛含Cl⁻高、熔铸性能差,所以这种方法已经在逐渐被淘汰。


②Kroll法
Kroll法与Hunter法基本一致,只是将还原剂金属Na更改为金属Mg。密闭的反应器中充满惰性气体,在高温下,熔融的金属Mg将TiCl₄还原为单质钛,这是目前工业最常用的生产钛的方法。相比Hunter法,Kroll法使用的还原剂Mg更加的安全和廉价,生成的钛含Cl⁻量也减少了,副产品MgCl₂还可以作为电解Mg的原料。但是这种方法工序多、反应时间长、耗能高且产品中常常含有铁杂质。

钙热还原法
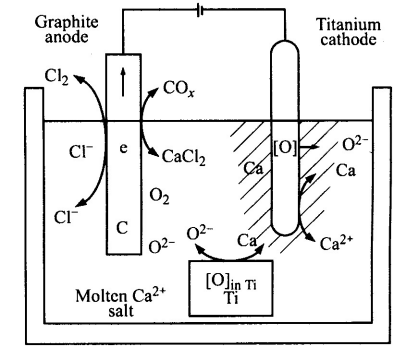
日本科学家小野胜石(Katsutoshi Ono)和铃木良助(Ryosuke O.Suzuki)在2002年发表了一种新型制备钛方法,即钙热还原法(OS)。钙热还原法是利用石墨作阳极、不锈钢作阴极,在熔融盐CaCl₂中电解CaO获得金属Ca,并利用该金属Ca还原TiO₂。这种方法同时进行CaO的电解和TiO₂的还原,大幅度降低了反应成本,而且实现了连续生产,能量利用率高,绿色环保。





图4:钙热还原法原理图
电化学还原法
电化学还原法(FFC剑桥法)是以石墨为阳极、TiO₂板为阴极,在熔融盐CaCl₂中电解。电解一段时间后,阳极释放氧气,阴极的TiO₂会还原为海绵状的Ti。这种方法使用低成本的TiO₂和无毒的CaCl₂,生产时间缩短、能量利用率高,节省生产成本,是一种新型绿色的冶金工艺。




熔融盐电解TiCl₄法
由于Hunter法与Kroll法利用金属还原TiCl₄生产钛无法实现连续化生产,科学家提出在惰性气体保护下,直接电解在熔融盐中的TiCl₄得到钛单质。但是这种方法仍存在很多问题,如TiCl₄在熔融盐中溶解度低、电流效率低、产生氯气污染环境,这使得这种方法并未实现工业化。





碘化钛热分解法
碘化钛热分解法是制备高纯钛的方法之一,分为传统碘化钛分解法和新碘化钛分解法。


日本住友钛公司发表了一种新的碘化钛分解法。与传统法不同的是,该方法是将气化的TiI₄与粗钛反应生成TiI₂,然后再加热至1100-1300 ℃使其分解。新方法制备的钛纯度高,并且该方法具有效率高、分解温度降低、可控制温度、减少杂质的优点。


应用领域
在医学领域的应用
钛和钛合金因其良好的可加工性、化学稳定性、耐腐蚀性、低弹性模量和优良的生物相容性,已被广泛用作临床骨科植入物,如可作人体的牙齿支架、膝关节、肘关节、髋关节等。纯钛的抗腐蚀性能虽好,但强度低,不适用于修复承载较大的骨头。置换或修复承载较大的骨头多用的是钛合金,常用的钛合金有Ti-6Al-4V、Ti-5Al-2.5Fe、Ti-6Al-7Nb。这些钛合金的强度高于纯钛,弹性模量接近于人体组织,加工性能也较好。但是已有研究证明,V、Al元素具有生物毒性,会损伤人体的器官,引起贫血、神经紊乱等症状,所以科学家们在研究其他更加合适的钛合金,如中国西北有色院研制的Ti-2Mo-2Zr-3Al合金,拉伸强度大、韧性好、耐磨损性能佳,但是弹性模量仍未达到骨弹性模量。英国医疗设备制造公司Smith&Nephew Richards研制的Ti-13Nb-13Zr合金,强度高、弹性模量低、生物相容好。
当钛及其合金用于骨修复和置换时,它们很容易引起细菌的粘附和聚集,从而导致术后感染。此外,钛及其合金有时难以与周围的组织发生融合,最终导致种植体松动。所以科学家也在研究在钛基材料表面修饰,赋予其抗菌活性和骨诱导特性。
在航天航空领域的应用
由于钛和钛合金具有低密度、重量轻、强度大、耐腐蚀、韧性强、耐疲劳性、耐高温、无磁性、能够减轻发射重量、增加射程等特点,所以钛和钛合金在航天航天方面广泛应用。在航天航空中使用的钛合金可以根据其性质分为高温钛合金、高强钛合金、损伤容限型钛合金、阻燃钛合金等。
钛和钛合金早在20世纪50年代已经应用于航空领域,主要应用在飞机骨架、蒙皮、燃料箱、发动机、舱门、起落架、机翼等多方面。如波音747、767、777等飞机钛含量均超过40 t,并且钛含量越来越高。飞机上使用的钛合金主要有Ti-6Al-4V、Ti-8Al-1M-1V、Ti-17、Ti-6242、Ti-6246。钛及其钛合金也可以用于制作飞船骨架、火箭发动机壳体、起落架、登月舱、燃料储存箱、压力容器等。早在20世纪60年代,第一艘载人宇宙飞船中使用了钛合金Ti-6Al-4V和Ti-5Al-2.5Sn,钛含量约占总机体重量的5%。日本的N-I、N-II、N-III火箭、“大角”卫星,中国的“神舟”飞船、“东方红”卫星,俄罗斯的“和平-1”号、“进步”号、“金星”号、“月球”号航天器也均使用了大量的钛合金。常用于航天领域的钛合金有Ti64、Ti-5Al-2.5Sn、Ti-7Al-4Mo、Ti-3Al-2.5V、Ti-13V-11Cr-3Al等。
在船舶的应用
钛和钛合金因在海洋条件下具有良好的耐腐蚀性和抗冲击震动、比强度大、密度小质量轻,可以用于制造船舶的耐压壳体、发动机零件、冷凝器、螺旋推进器、通海管道、声学和光学设置等,已经应用在民用船、水面艇、核潜艇、气垫船、原子能破冰船、水翼船等船舰上。如美国制备的“海崖”号潜水艇使用钛合金作耐压壳材料,装备了钛观察舱。日本的潜水艇“深海6500”使用了Ti-6Al-4V合金,二者的下潜深度均超过6000 m。常用于制作船舶零件的除了工业纯钛,还有钛合金Ti-6Al-4V、Ti-0.3Mo-0.8Ni、Ti64、Ti-3Al-8V-6Cr-4Mo-4Zr、Ti-6Al-2Nb-1Ta-0.8Mo、Ti-3Al-2.5V、Ti75、Ti31等。
在化学工业的应用
钛和钛合金可以代替不锈钢或其他材料制作多种化工设备和机械零件,因为钛和钛合金具有优良的耐腐性能,可以延长设备使用时间。钛和钛合金可以制作成耐腐蚀容器、电解槽、加热器、蒸发器、冷却器、浓缩器、各类阀门和泵等。具有代表性的是在氯碱工业中应用,钛和钛合金制作的电解槽对氯离子的耐腐蚀性能优于传统的石墨阳极电解槽,不仅可以延长设备寿命,还能节约能量、降低成本。
在生活中的应用
钛及钛合金制品已经在生活中随处可见了。钛及其钛合金可以制作多种运动器材和生活用品,如制作成短跑鞋钉,高尔夫球杆头,滑雪冰刀,网球拍、羽毛球拍、长曲棍球棒等运动器材的外壳,眼镜架,击剑保护面罩等。钛及其钛合金也可以制作生活常见物品的零件,如汽车、摩托艇、残疾人轮椅、自行车、电脑、手表、手机、游戏机等物品的零件。
安全事宜
危险性
钛粉末是易燃易爆炸物,在常温下的空气中,静电、摩擦等作用下就会发生剧烈燃烧或爆炸。钛粉末在空气中燃烧时,会产生对人体有害的氧化钛。
图示 |  |  |
图意 | 易燃 | 有刺激性 |
GHS分类:
H228(32%):易燃固体[危险易燃固体]
H250(22%):如果暴露在空气中会自发着火[危险的自燃液体;自燃固体]
H315(31%):引起皮肤刺激[警告皮肤腐蚀/刺激]
H319(31%):引起严重眼睛刺激[警告严重眼睛损伤/眼睛刺激]
H335(31%):可能引起呼吸道刺激[警告特定靶器官毒性,单次接触;呼吸道刺激]
储存条件
钛应储存于密闭容器中,容器放置在阴凉、通风的库房。存放处应远离火种、热源,禁止使用易产生火花的设备和工具,避免发生剧烈燃烧和爆炸事件。
急救措施
若不小心食入钛时,饮足量温水,适当催吐后立即前往医院就医。若不小心吸入钛粉末等,应立即转移至空气新鲜处。若发生呼吸困难的症状,请给患者输氧并立即前往医院就医;若发生呼吸、心跳停止的症状,请立即进行心肺复苏术并送往医院。若皮肤接触钛时,脱去沾染的衣服,用肥皂水和清水彻底冲洗皮肤,如有不适感请立即前往医院就医。若眼睛接触钛时,分开眼睑,用流动清水或生理盐水冲洗,如有不适感请立即前往医院就医。


