粘附分子(粘附分子)

VLoG
次浏览
更新时间:2023-05-23
粘附分子
基本信息
| 中文名 | 粘附分子 |
| 外文名 | adhesion molecules |
| 作用的形式 | |
| 粘附分子 | 介导细胞或细胞间相互接触 |
| 功能 | 配体结合的形式发挥作用 |
| 分类 | 黏附分子是以黏附功能来归类 |
| 所在领域 | 生物 |
收起
分子介绍
细胞粘附分子(cell adhesion molecules,CAM)是众多介导细胞间或细胞与细胞外基质(extracellular matrix,ECM)间相互接触和结合分子的统称。
发挥作用的形式:以受体—配体结合的形式。
命名:粘附分子与CD分子是根据不同角度的命名。粘附分子是以粘附功能来归类,CD分子是用单抗识别、归类而命名,范围十分广泛,其中包括了粘附分子组,因此大部分粘附分子已有CD的编号,但也有部分粘附分子尚无CD编号。
粘附分子是介导细胞或细胞间相互接触和结合分子的统称,位于细胞表面或细胞基质中的糖蛋白,并以受体和配体结合的形式发挥作用。粘附分子使细胞与细胞间,细胞与基质间发生粘附,参与细胞的识别,活化和信号传导,细胞增值与分化,细胞的伸展与运动,使免疫应答,炎症发生,凝血,肿瘤转移,创伤愈合等一系列重要生理和病理过程的分子基础。
粘附分子以配体一受体相对应的形式发挥作用,导致细胞与细胞间、细胞与基质间或细胞-基质-细胞之间的粘附,参与细胞的信号转导与活化、细胞的伸展和移动、细胞的生长及分化、炎症、血栓形成、肿瘤转移、创伤愈合等一系列重要生理和病理过程。
对于细胞间相互接触、粘附的现象人们早有认识。由于单克隆抗体技术和分子生物学技术的发展和应用,极大地推动了对粘附分子的研究,使人们得以从分子水平上提出粘附分子的概念,并逐渐认识其作用机理。已基因克隆成功的粘附分子有几十种,形成一个庞大的粘附分子大家族。由于粘附分子所具有广泛、重要的生物学功能功能,在细胞生物学、分子生物学、免疫学、病理生理学、肿瘤学以及其它生命科学领域里已受到人们普遍的关注,1993年第五届人白细胞分化抗原国际专题讨论会上,已将粘附分子单独列为一组新抗原。
在体内,一种细胞可能同时表达多种粘附分子,一种粘附分子也可以表达于多种不同的组织细胞,而细胞间的相互粘附作用又可能由多对粘附分子受体/配体共同参与,单从某一对粘附分子的作用难于了解细胞粘附作用的全过程。
分类
粘附分子根据其结构特点分
1、整合素家族
2、选择素家族
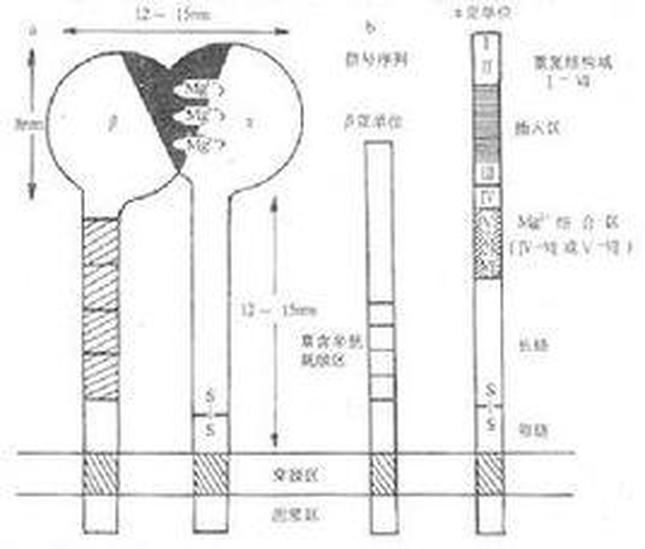
选择素分子的基本结构
选择素分子为穿膜的糖蛋白、可分为胞膜外区、穿膜区和胞浆区。选择素家族各成员胞膜外部分有较高的同源性,结构类似,均由三个功能区构成:①外侧氨基端(约120个氨基酸残基)均为钙离子依赖的外源凝集素功能区(calcium dependent lectin domain),可以结合碳水化合物基团,是选择素分子的配体结合部位;②紧邻外源凝集素功能区的表皮生长因子样功能区(epidermal growth factor like domain, EGF样区),约含35个氨基残,EGF样功能区虽不直接参加与配体的结合,但对维持选择素分子的适当构型是必需的;③靠近膜部分是数个由约60个氨基本酸残基构成的补体结合蛋白(complement binding protein)重复序列。各种选择素分子的穿膜区和胞浆没有同源性。选择素分子的胞浆区与细胞内骨架相联。
选择素家族的组成
选择素家族组成,分子量(kD),分布,配体和功能
L-选择素(CD62L)(LAM-1,LECAM-1) 9p75~80 白细胞 CD15s(S-Lewis)在外周淋巴结HEV上PNAd 白细胞与内皮细胞粘附,向炎症部位游走,淋巴细胞归巢到外周淋巴淋巴结
P-选择素(62P)(GMP-140,PAGEM) 9p140 贮存于巨核细胞、血小板α颗粒和血管内皮细胞,Weibel Palade小体,凝血酶和组胺诱导后表达于细胞表面 CD15a(S-Lewisx)CD15 白细胞与内皮细胞和血小板粘附
注:LAM:白细胞粘附分子;ELAM:内皮细胞白细胞粘附分子;LECAM:白细胞内皮细胞粘附分子:PNAd:外周淋巴结定居素;GMP:颗粒蛋白:Slewis:唾液酸化的路易斯寡糖;PADGEM:血小板活化依赖的颗粒外膜蛋白 CLA:皮肤淋巴细胞相关抗原
选择素分子识别的配体
与其它粘附分子不同,选择素分子识别的配体都是一些寡糖基团,主要是具有唾液酸化的路易斯寡糖(Sialyl-Lewis)或类似结构的分子。与蛋白质分子抗原不同,直接决定细胞表面某种寡糖表达的因素,主要是与某些特的糖基转移酶或碳水化合物修饰酶的作用有关。这些酶的作用可能与细胞的生长与代谢状态有密切关联。一种寡糖基团可以存在于多种糖蛋白或糖脂分子上,并分布于多种细胞表面,因此选择素分子的配体在体内的分布较为广泛。已发现然白细胞、血管内皮细胞、某些肿瘤细胞表面及血清中某些糖蛋白分子上都存在有选择素分子识别的碳水化合物基因。
最初发现一种介导细胞间相互聚集的粘附分子,在有Ca2+存在时可以抵抗蛋白酶的水解作用。以后又发现另外两种作用和特性与其类似的粘附分子,它们的氨基酸组成也有同源性,因此将其命名为钙离子依赖的粘附分子家族(Ca2+ dependent cell adhesion molecule family,Cadherin家族)。钙离子依赖的粘附分子家族的粘附分子对于生长发育过程中细胞的选择性聚集具有至关重要的作用。
(1)Cadherin分子结构
Cadherin分子均为单链糖蛋白,约含723-748个氨基酸残基,不同的Cadherin分子在氨基酸水平上有43%-58%的同源性。Cadherin分子由胞浆区、穿膜区和胞膜外区三部分组成,其胞膜区有数个重复功能区,并含有由3-5个氨基酸残基组成的重复序列。近膜部位含有4个保守的半胱氨酸残基,分子外侧N端的113个氨基酸残基构成Cadherin分子的配体结合部位。此外胞膜外部分具有结合钙离子的作用。Cadherin分子的胞膜内部分高度保守,并与细胞内骨架相连。
(2)Cadherin家族的组成和分布
目前已知Cadherin家族共有3个成员,E-Cadeherin、N-Cadherin和P-Cadherin。不同的Cadherin分子在体内有其独特的组织分布,它们的表达随细胞生长发育状态的不同而改变。Cadherin分子以其独特的方式相互作用,其配体是自身相同的Cadherin分子。
表6-6 Cadherin家族的组成、分布及其配体
Cadherin家族成员 分子量(kD)分布 配体 E-Cadherin 124 上皮组织 E-Cadherin N-Cadherin 127 神经组织、横纹肌、心肌 N-Cadherin P-Cadherin 118 胎盘、间皮组织、上皮组织 P-Cadherin
4、免疫球蛋白家族
在参与细胞间相互识别、相互作用的粘附分子中,有许多分子具有与lgV区或C区相似的折叠结构,其氨基酸组成也有一定的同源性,属于免疫球蛋白超家族(immunoglobulin superfamily,IGSF)的成员。免疫球蛋白超家族粘附分子的种类、分布及其配体见表6-4。免疫球蛋白超家族粘附分子的配体多为免疫球蛋白超家族中的粘附分子或粘合素超家族的粘附分子,在这种情况下,相互识别的一对IGSF分子或粘合素免疫球蛋白超家族粘分子实际上是互补配体的关系。
5、其他尚未归类的粘附分子
除了上述四为类粘附分子外,还有一些粘附分子目前尚未归类,包括一组作为selectin分子的配体的CD15、CD15s(s-Lewis),此外,还有CD44、MAd、MLA等粘附分子。
粘附分子参与机体许多重要的生理和病理过程,主要包括:①通过表达于白细胞粘附分子CD11a/CD18、CD11b/CD18、CD11c/CD18、VLA-4、L-selectin、CD15、CD15s、和P-selectin相互粘附,参与炎症的发生;②通过表达于淋巴细胞上的归巢(Iymphocyte homing receptor,LHR)、L-selectin、CLA、LFA-1、VLA-4、CD44、LPAM-2分别与表达于血管内皮细胞上的定居素(addressin)PNAd、E-selectin、ICAM-1、ICAM-2、VCAM-1、MAd、CAM相互粘附使淋巴细胞向外周淋巴器官,皮肤炎症部位或粘膜相关淋巴组织的回归;③通过CD/MHCⅡ类分子非多态部分、CD8/MHC1类分子非多态部分、LFA-1/ICAM-1、LFA-2/LFA-3、CD28/B7的相互作用参与免疫应答中APC呈提抗原、抗原识别、免疫细胞相互协作以及CTL杀伤靶细胞等多个环节;④通过Cadherin、N-CAM、CD31等分子的自身粘附,以及某些粘附分子与细胞外基质的粘附,参与细胞的发育、分化、附着及移动;⑤E-Cadherin、家庭些成员以及CD44分子等与肿瘤的浸润、转移有关;⑥通过血小板表达的粘附分子参与动脉、静脉中血栓形成以及其它形式的凝血过程。
功能
粘附分子的功能:
参与机体多种重要的生理功能和病理过程。
(一)免疫细胞识别中的辅助受体和协同活化信号:协同T细胞的粘附分子常见的有CD86 、 CD4/MHCⅡ类分子、CD8/MHCⅠ类分子、 CD28/ CD80 或CD2/ CD58 、 LFA-1/ICAM-1等。
(二)参与炎症过程中白细胞与血管内皮细胞粘附:如LFA-1/Mac-1等。
(三)淋巴细胞归巢(lymphocyte homing)
定义:是淋巴细胞的定向游动,包括淋巴干细胞向中枢淋巴器官归巢,成熟淋巴细胞向外周淋巴细胞归巢,淋巴细胞再循环,以及淋巴细胞向炎症部位迁移。其分子基础是称之为淋巴细胞归巢受体( lymphocyte homing receptot,LHR)的粘附分子与内皮细胞上相应的地址素(adressin)粘附分子的相互作用。
(五)参与细胞的移动
(六)参与肿瘤的浸润与转移
表达调节
密切相关
细胞粘附分子不仅具有多种生理功能,在一定条件下也与病理过程的发生密切相关。在细胞因子、炎症介质以及其它因素的作用下,细胞表面粘附分子表达的水平和构型可以发生改变,导致细胞粘附能力的变化。体内某些粘附分子的表达是组成性(constitutive)的,即通常状态下细胞表面就有一定水平的表达,如CD11/CD18、ICAM-1、ICAM-2和L-selectin等粘附分子在相应细胞的静止状态下有一定水平的表达,在某些因素的作用下,这些粘附分子的表达也可发生上调或下调(up-regulation or down-regulation)。另外一些粘附分子的表达可以是非组成性(non-constitutive)的,即通常状态下这些粘附分子在细胞表面表达很少或不表达,但在某些因素的作用下可诱导表达,如E-selectin、VCAM-1在内皮细胞的表达即属此类。对粘附分子表达的调节有构型调节和表达数量调节两种方式,关于粘附分子表达调节的资料大多来自于对白细胞与内皮细胞粘附作用的研究。
粘附作用
除了通过增加或降低粘附分子表达水平来调节细胞粘附能力外,某些因素还可以通过改变粘附分子的构型影响其与配体结合的亲和力,从而调节细胞的粘附能力,这使得对细胞粘附作用的调节更为精细和复杂。
(一)LFA-1分子构型改变对其粘附作用的影响
淋巴细胞在受到外来抗原,PMA,抗CD2、CD3、CD44、CD43或抗MACⅡ类分子单克隆抗体的刺激作用活化后,可发生相互凝集,这种凝集作用依赖于LFA-1/ICAM-1的相互作用,而这两种粘附分子在活化淋巴细胞的表达水平并没有显着增加。静止淋巴细胞即表达一定水平的LFA-1和ICAM-1,NK细胞和某些CTL细胞系更是表达较高水平的LFA-1/ICAM-1分子,但它们并不发生凝集作用。在淋巴细胞活化后,粘附分子可能通过构型变化的方式,提高LFA-1/ICAM相互作用的亲和力,从而提高活化淋巴细胞的粘附能力。
1.NKI-L16和活化状态的LFA-1分子NKI-L16是一种抗LFA-1的单克隆抗体,其识别的表位在静止淋巴细胞暴露的水平很低。当NKI-L16McAb与淋巴细胞表面的LFA-1作用后,不仅不阻断LFA-1介导的粘附作用,反而可以诱导静止淋巴细胞的相互粘附而使细胞发生凝集。这种诱导粘附作用的机理部分是由NKI-L16McAb改变了LFA-1分子的构型,诱导了NKI-L16识别的表位在静止淋巴细胞的表达。NKI-L16识别表位的表达是粘附作用发生的重要条件,但并不是唯一的,因为CTL细胞虽表达高水平的NKI-L16表位却并不发生自发凝集。目前研究认为,LFA-1分子至少以三种形式存在:(1)静止淋巴细胞表达的LFA-1分子,暴露很少的NKI-L16表位,与ICAM-1分子结合的亲和力(affinity)低;(2)中间状态的LFA-1分子,暴露出大量的NKI-L16表位,但与ICAM-1结合的亲和力仍较低;(3)活化状态的LFA-1分子,暴露出大量高亲和力的NKI-L16表位。不同状态的LFA-1分子在淋巴细胞表面的分布方式是不同的,静止淋巴细胞的LFA-1分子分布分散,而活化的外周血淋巴细胞、CTL克隆、效应T淋巴细胞以及活化的CTL克隆细胞的LFA-1分子呈集中分布,在局部形成高密度的LFA-1分子区域,这可能与NKI-L16表位的暴露有关。LFA-1分子在局部形成高密度状态可以提高其与配体结合时的亲合力(avidity)。
在integrin家族中,这种精细的构型调节作用并不仅限于LFA-1分子,已发现VLA-4分子同样存在着静止、部分活化和活化三种要构型,活化的VLA-4分子可与VCAM-1和纤粘连蛋白相结合,部分活化的VLA-4分子仅结合VCAM-1分子,而静止状态的VLA-4分子则失去结合任何配体的能力。
2.Ca2 、Mg2 与LFA-1分子活化状态的关系Ca2 和Mg2 的存在对LFA-1分子与配体的结合是必需的,在粘附试验系统中加入金属离子螯合剂(EDTA或EGTA)去除反应系统中的Ca2 和Mg2 可以完全抑制LFA-1与其配体的结合。采用单克隆抗体对LFA-1分子表位的表达进行检测,发现Ca2 与Mg2 与LFA-1分子某些表位的表达有关,而这些表位的表达是LFA-1分子活化构型的标志。如上述NKI-L16识别表位的表达需要有Ca2 存在;另外一株单克隆抗体24(McAb24)识别的表位在LFA-1、Mac-1和gp150、90均有表达,但依赖Mg2 的存在。PMA或抗细胞表面分子的单克隆抗体作用引起的细胞凝集有一过性持续性两种,一过性的作用在半小时之内消失,而持续性的作用可维持2小时以上。这种现象与离子依赖种类有一定的关系,PMA、NKI-L16、抗CD2和CD44单克隆抗体可以引起持续性的LFA-1分子的活化,它们的作用只依赖Mg2 的存在;而抗CD3、CD43和MHC-Ⅱ类分子的单克隆抗体所引起的凝集是一过性的,它们的作用则依赖Ca2 与Mg2 的同时存在。
3.LFA-1分子构型改变的机理对于淋巴细胞活化后导致LFA-1分子构型改变的机制还不十分明了。实验表明,PMA作用于淋巴细胞后,通过激活蛋白激酶C(PKC)使LFA-1分子β链发生磷酸化,很可能与LFA-1分子构型的改变有关。抗CD2或CD3单克隆抗体可以通过影响磷酸肌磷酸肌醇代谢途径导致PKC的激活,但两种McAb影响淋巴细胞粘附分子活化的过程是不同的,抗CD2单克隆抗体诱导持久的LFA-1分子活化,而抗CD3单克隆抗体只能诱导短暂的、一过性的LFA-1分子的活化。这种对粘附分子表达的负反馈调节机制,对于体细胞粘附作用的调节过程可能有重要的意义。体内对粘附作用的负调节意味着细胞可以与相互作用的靶细胞脱离,再作用于其它靶细胞,从而最大限度地发挥作用。前面曾提到McAb24识别的表位表达在活化状态的LFA-1分子,McAb24并不阻断LFA-1分子和Mac-1分子与配体的结合,但却可以明显抑制单核细胞向T细胞的抗原提呈作用、LAK细胞对靶细胞的杀伤作用以及中性粒细胞的趋化移动,这些过程均依赖LFA-1和Mac-1分子与其配体的相互作用。单独CD3单克隆抗体只引起一过性的LFA-1分子的活化,而同时加入McAb24则造成持续性LFA-1分子的活化,提示McAb24可能阻止LFA-1分子由活化状态转变为非活化状态。
(二)其它粘附分子构型的改变对粘附作用的影响
除LFA-1分子外,在integrin家族中其它一些粘附分子构型的改变也可以影响细胞的粘附能力。PMA、抗CD2或CD3单抗可以诱导或增强淋巴细胞的VLA-4(CD49d/CD29)、VLA-5(CD49e/CD29)和VLA-6(CD49f/CD29)与其配体(层粘连蛋白或纤粘连蛋白)的粘附作用,提示上述粘附分子可能通过与LFA-1相类似的机制发生构型变化,导致与配体结合的亲和力升高。Mac-1分子(CD11b/CD18)及血小板糖蛋白GPⅡbⅢa(CD41/CD61)分子在细胞活化后可以暴露新的表位,是其分子构型发生改变的直接证据。
获得selectin家族粘附分子构型变化影响粘附能力的直接证据,但某些抗L-seletin或抗E-selectin分子EGF结构域的单抗非但不阻断L-selectin分子或E-selecti分子与相应配体的结合,反而具有促进作用,提示selectin家族粘附分子中同样存在着分子构型变化对粘附能力调节的可能性。
作用的调节
粘附分子表达数量的改变是粘附作用调节的另一个重要方面。粘附分子构型改变与表达数量的增减并不是截然分开的两个过程,两者可能同时存在,共同完成对粘附作用的调节。如淋巴细胞活化后不仅粘附分子构型改变导致亲和力增加,同时也伴有粘附分子数量的增加。
1.调节细胞表面粘附分子表达数量的方式 细胞表面粘附分子表达数量的调节方式主要有诱导贮存在细胞内的粘附分子转移到细胞表面和诱导粘附分子的重新合成两种方式。转移形式的过程发生迅速,只需数秒钟,但维持时间短暂。如凝血酶和组胺作用于内皮细胞可以诱导内皮细胞内贮存在CD62分子迅速转移到细胞表面,然后又很快被内吞而消失;又如CD11b/CD18、CD11c/CD18贮存在中性粒细胞的胞浆颗粒内,在PMA、TNF、IL-1刺激后迅速转移到细胞表面。重新合成过程发生较为迟缓,一般需数小时,但维持时间较长。IL-1、TNF-α作用于血管内皮细胞则可以诱导E-selectin、VCAM-1分子的重新合成与表达,诱导后4小时达到高峰,并可维持24小时以上。
2.细胞因子、炎症介质对粘附分子表达的调节细胞因子IL-1、IL-3、IL-4、IL-8、PAF、GM-CSF、TNF-α、TNF-β和IFN-γ以及炎症介质白三烯、组胺和凝血酶等可作用于白细胞或/和血管内皮细胞,调节白细胞与血管内皮细胞的粘附作用。在体内可能有多种调节因素同时存在,相互影响,并可能有更多的未知的因素参与细胞间粘附的调节过程。
3.细胞的生长、发育状态对粘附分子表达的影响 除了上述细胞因子、炎症介质可以调节细胞粘附分子的表达外,细胞本身的生长、发育、分化及代谢状态也可以影响粘附分子的表达。在胚胎发育过程中,组织细胞粘附分子的表达接一定的规律发生改变,使得不同细胞得以按一定的规律组合在一起,形成不同的组织或器官。肿瘤细胞与其起源的正常组织细胞相比其表达的粘附分子可有很大差异,这可能是某些肿瘤细胞易发生浸润、转移等现象的分子基础。此外,处于不同分化和发育状态的淋巴细胞表达粘附分子也有明显改变,如与未经抗原刺激的T细胞(naive T cell)相比,记忆性T细胞(memory T cell)表达更多的CD2、LFA-1、CD44、VLA-4等粘附分子,而L-selectin在naive T细胞表达水平要明显高于记忆T细胞。
粘附功能
不同粘附分子在粘附过程不同阶段所起的作用
炎症过程的一个重要特征就是白细胞粘附、穿越血管内皮细胞,向炎症部位渗出。这一过程一个重要的分子基础是白细胞与血管内皮细胞粘附分子的相互作用,表2-7例举了参与这一过程的粘附分子。不同白细胞的渗出过程或渗出过程的不同阶段所涉及的粘附分子不尽相同。
不同粘附分子在粘附过程不同阶段所起的作用 在体内由于血液处于不断流动状态,白细胞与血管内皮细胞的粘附作用是在血液流动产生的切力作用下进行的,因此白细胞与血管内皮细胞的相互粘附作用有其特殊性。体内白细胞与血管内皮细胞的粘附作用包括白细胞沿血管壁流动的最初粘附作用,以及随后的加强粘附和穿越内皮细胞的过程。为了模拟体内血液流动状态,在体外研究白细胞与血管内皮细胞的粘附作用时,采用了特殊的实验装置,使培养液中的中性粒细胞不断流动通过培养状态的单层内皮细胞。实验表明,在流体产生的切力作用下,CD11/CD18与其配体ICAM-1对于中性粒细胞与血管内皮细胞的最初粘附几乎不起作用。相比之下,L-seletin分子与其配体E-selectin的结合则发挥重要的作用,抗L-selectin分子的单克隆抗体可明显阻断这种最初的粘附作用。在随后发生的中性粒细胞与血管内皮细胞加强粘附并穿越血管内皮细胞的过程中,L-selectin分子与其配体的结合则几乎不起任何作用,而CD11/CD18与其配体的相互作用上升到关键地位。已经粘附于血管内皮细胞的中性粒细胞L-selcetin分子表达水平显著下降,在趋化因子(如膜结合IL-8)的诱导下,CD11/CD18表达水平则明显升高。事实上,L-selectin分子表达下降可减少对已粘附中性粒细胞的牵拉作用,有利于CD11/CD18介导的中性粒细胞的穿越血管内皮细胞过程。
在白细胞与血管内皮细胞粘附过程中的作用
膜结合细胞因子在白细胞与血管内皮细胞粘附过程中所起的作用 调节上述白细胞粘附分子表达的细胞因子有血管内皮细胞膜表面结合的IL-8、GM-CSF、PAF等对中性粒细胞具有趋化作用的细胞因子,血管内皮细胞所合成的上述细胞因子主要以膜结合(membrane-bound)的形成表达于血管内皮细胞表面。中性粒细胞与血管内皮细胞的粘附过程是在血管内皮细胞膜结合细胞因子调节作用下多种粘附分子按顺序协调作用的复杂过程。
在中性粒细胞粘附、穿越血管内皮细胞的过程中,IL-8、GM-CSF和PAF等细胞因子发挥着关键的调节作用,没有上述细胞因子的作用,最初粘附到血管内皮细胞的中性粒细胞可能重新回到血流中去。膜结合细胞因子的存在作用其特殊意义,它可以使细胞因子的作用局限化,促进白细胞的粘附、渗出、游离的细胞因子(IL-8等)作用于白细胞减少其L-selectin分子的表达,反而抑制白细胞的粘附、渗出。血管内皮细胞表面不同的膜结合细胞因子不同白细胞粘附作用的选择性激活可能是选择白细胞粘附、渗出过程的因素之一。
淋巴细胞的粘附、渗出过程可能采取相似的方式,只是所涉及的粘附分子及粘附激活机制有所不同。即最初是由seectin分子介导的淋巴细胞与血管内皮细胞的不稳定的粘附,随后血管内皮细胞的膜结合细胞因子作用于淋巴细胞激活其integrin分子,导致加强粘附及穿越血管内皮细胞的过程。
粘附分子在白细胞渗出过程中的重要作用在先天性白细胞粘附缺陷症(leukocyte adhesion deficiency,LAD)发病机理中得到了证实。该病的临床特征是反复发生难以治愈的感染。LAD可分为LAD-1和LAD-2两型。LAD-1型患者白细胞CD11/CD18分子表达缺陷,因此不能与FN和C3bi结合,丧失非特异的调理作用;此外,虽然白细胞可以沿血管壁流动,由于不能与血管内皮细胞表面粘附分子ICAM-1结合,白细胞不能渗出到炎症部位。LAD-2型患者白细胞S-Lewisx(CD15s)表达缺陷,不能有效的与E-selectin分子结合,白细胞沿血管壁的流动能力显著低于正常人,同样也不能向炎症部位渗出。因此阻断白细胞与血管内皮细胞的粘附和白细胞的渗出有可能成为预防和治疗性疾病的一种新的手段。
细胞因子在白细胞选择性渗出过程中的作用
细胞因子在白细胞选择性渗出过程中的作用:不同炎症具有不同类型的炎细胞浸泣,如急性炎症以中性粒细胞渗出和浸润为主,慢性炎症往往以淋巴细胞浸润为主,Ⅰ型超敏反应的变态反应性炎症以嗜碱性粒细胞的选择性渗出为主,迟发型超敏反应性炎症则以单核细胞、T细胞浸润为特征。虽然对白细胞选择性渗出的机理还不完全明了,但已有的证据显示粘附分子在不同类型白细胞表达的差异以及细胞因子对粘附分子表达的不同调节作用可能是重要的因素。如IL-4和IFN-γ作用于血管内皮细胞可以选择性地诱导粘附性粒细胞表达,在中性粒细胞不表达,因此IL-4和IL-4和IFN-γ可以选择性的促进除中性粒细胞以外的白细胞的粘附作用。IL-4和IFN-γ是由活化T淋巴细胞产生的细胞因子,炎症局部活化T淋巴细胞可能通过产生IL-4和IFN-γ等细胞因子作用于局部血管内皮细胞,促进白细胞的渗出,因此IL-4和IFN-γ可能在免疫介导的炎症性疾病中发挥重要作用。此外,IL-8、GM-CSF和PAF等膜结合细胞因子也可能是导致白细胞选择性渗出的重要因素。
与淋巴细胞
是淋巴细胞迁移的一种特殊形式
淋巴细胞
对于骨髓产生的T细胞前体(Pro-Tcell)向胸腺归位的机理尚缺乏深入的研究。已知T细胞祖细胞表达CD44与L-selectin分子,它们可能与T细胞祖细胞的归巢有关。此外,胸腺血管内皮细胞表达一种被称为EA1的分子,可能起到地址素的作用参与T细胞的归巢过程。认为integrin中α6β1、α6β4对T细胞前体的粘附起重要作用。
淋巴细胞向外周淋巴器官的归巢
淋巴细胞向外周淋巴器官的归巢主要有淋巴细胞向外周淋巴结、派伊尔小结(Peyre's Patch)及脾脏的选择性归巢等几种不同的途径。
1.淋巴细胞向外周淋巴结的归巢 L-selectin是决定淋巴细胞向外周淋巴结选择性归巢的归巢受体,其相应配体为特异性表达于外周淋巴结血管地址素(perpheral lymphonodevascular addressin PNAd)。L-selectin分子与PNAd相结合介导了淋巴细胞与外周淋巴结血管内皮细胞最初的粘附,随后参与粘附与穿越过程的粘附分子主要有LFA-1/ICAM-1、ICAM-2及CD44/MAd分子。
2.淋巴细胞向派伊尔小结的归巢 integrinα4β7分子是淋巴细胞向派伊尔小结定向归巢的特异归巢受体,抗α4β7的抗体可特异性地阻断淋巴细胞向派伊尔小结的归巢过程,而对淋巴细胞向外周淋巴结的归巢过程无明显影响。integrinα4亚单位可与β1、β2、βρ等β亚单位结合,分别组成α4β1、α4β7和α4βρ,并表达在不同的淋巴细胞表面,可能与特定淋巴细胞群或亚群的定向归巢有关。派伊尔小结的静脉高内皮细胞专一的、高水平表达粘膜血管地址素(mucosal vascular addressin MAd)。MAd是一种分子量为60kDa的糖蛋白,其对应的淋巴细胞归巢受体是integrin α4β7,两者的相互作用构成了特定淋巴细胞群向派伊尔小结定向归巢的基础。CD44及LFA-1分子作为淋巴细胞归巢受体与其配体MAd和ICAM-1、ICAM-2的相互作用也参与淋巴细胞向派伊尔小结的归巢过程,但它们与α4β不同,除参与淋巴细胞向派伊尔小结归巢外,还参加向其它外周淋巴器官的归巢。
淋巴细胞向非淋巴组织的归巢
正常的非淋巴组织没有或只有少量淋巴细胞,但在炎症状态下,淋巴细胞可以大量浸润。淋巴细胞向非淋巴组织的归巢可以区分为以下两种情况:(1)正常的皮肤及消化、生殖道粘膜组织中有特定表达γδ型T细胞受体(TCRγδ)的淋巴细胞群存在,它们可能直接来自中枢淋巴器官,这些淋巴细胞的归巢过程所涉及的粘附分子还不清楚。此外,正常皮肤或粘膜等组织中经常存在有少量记忆淋巴细胞,可能是少量抗原持续刺激的结果。(2)淋巴细胞向炎症状态下的非淋巴组织的归巢。在炎症组织中浸润的淋巴细胞多为记忆性T细胞,这些T细胞表达较高水平的CD45RO,此外,LFA-1、ICAM-1,α4-integrin、LFA-3,CD44等粘附分子的表达也明显高于天然(naive)T淋巴细胞。上述粘附分子相对高表达可能与记忆T细胞向炎症部位的选择性渗出有关。
淋巴细胞向非淋巴组织的归巢过程除了具有记忆T细胞的选择性外,还有组织特异性,也就是就特定的淋巴细胞群选择性的定向归巢到皮肤、粘膜或滑膜等组织。
1.淋巴细胞向皮肤炎症部位的归巢 皮肤炎症部位的血管内皮细胞表达高水平的E-selectin分子,而向皮肤炎症部位定位归巢的记忆T细胞则表达皮肤淋巴细胞相关抗原(cutaneous lymphocyte associated antigen, CLA),E-selectin与CLA的相互作用是CLA阳性记忆T细胞向皮肤炎症部位定向归巢的分子基础。此外,VLA-4与VCAM-1,LFA-1与ICAM-1/ICAM-2的相互作用也与淋巴细胞向皮肤炎症部位的归巢过程有关。
2.淋巴细胞向肠道粘膜炎症部位的归巢 目前关于这一过种的研究资料还不多。粘膜组织中的淋巴细胞表达一种称为MLA(mucosal lymphocyte antigen)的表面抗原,由integrin分子β7链与另一条不同于α4链的多肽链组成,可能与淋巴细胞向肠道粘膜的归巢过程有关。
3.淋巴细胞向滑膜炎症部位的归巢 目前已知LFA-1/ICAN-1、VLA-4/VCAM-1及CD44/MAd都参与淋巴细胞向滑膜组织的归巢过程,但还不能解释淋巴细胞向滑膜组织归巢过程的选择性。推测可能还有未被发现的决定淋巴细胞向滑膜组织定向归巢的粘附分子。
淋巴细胞归巢过程中激活粘附作用的分子
前已述及,淋巴细胞的归巢与中性粒细胞渗出的过程是相似的。同样,淋巴细胞归巢过程中最初粘附后粘附作用的激活机制也与中性粒细胞的渗出过程类似。
1.具有趋化作用的多肽 巨噬细胞炎症蛋白-1(macrophage inflammatory protein-1,MIP-1)可以膜结合的形式存在于淋巴结或炎症组织血管内皮细胞表面,通过作用于CD8 T细胞使其与血管内皮细胞粘附作用增强,这种粘附作用的增强是由T细胞VLA-4与血管内皮细胞VCAM-1分子相互作用介导的。此外,趋化因子家族的RANTES对记忆T细胞具有选择趋化作用。不同的趋化多肽对特定淋巴细胞群粘附作用的激活可能与淋巴细胞的选择性归巢有关。
2.粘附分子介导的粘附激活作用 抗CD2和抗CD3单克隆抗体作用于T淋巴细胞可使T细胞表面integrin分子构型改变而使其与配体结合的亲和力增加。此外,淋巴细胞其它表面分子在与配体结合后可能通过相同或不同的机制影响粘附分子间相互结合的亲和力。可能具有上述作用的粘附分子有CD15、CD31和VLA-4。(1)抗CD15单克隆抗体与结合于LFA-1分子的CD15结合后,通过LFA-1分子构型的改变使其与ICAM-1粘附作用增强。血管内皮细胞表达的E-selectin分子可能模拟抗CD15单克隆抗体的作用,与CD15结合后导致淋巴细胞LEA-1与其配体ICAM-1粘附作用的激活。(2)抗CD31的单克隆抗体作用于CD8 T细胞可激活VLA-4/VCAM-1介导的粘附作用,淋巴细胞CD31分子与其血管内皮细胞配体的作用可能导致相同结果。(3)VLA-4与其配体VCAM-1结合对其自身的粘附具有正反馈调节作用。由于表达CD31的细胞多为天然T细胞,VLA-4的表达局限于部分T细胞,因此CD31和VLA-4对粘附作用的激活可能与不同的淋巴细胞群的定向归巢有关。
淋巴细胞的归巢是一个多种粘附分子参与并受各种因素调节的复杂过程,对于这一过程还缺乏系统的、确切的认识。随着免疫生物学和分子免疫学研究的进展,必将推动这一重要领域的深入研究,并为某些疾病的诊断、预防和治疗提供一条崭新的途径。
与免疫细胞

细胞
与细胞活动
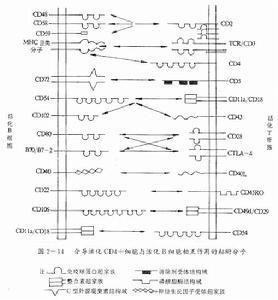
粘附分子参与细胞间的附着
在胚胎发育过程中,不同类型的细胞按着既定的规律形成细胞与细胞之间及细胞与细胞外基质的附着,有序地组合在一起构成不同的组织和器官。在这一过程中,粘附分子发挥着重要作用。
粘附分子参与细胞发育
粘附分子参与细胞与基质的附着
细胞与细胞间基质的附着是细胞生存与增殖所必需的,这种附着主要由integrinpe家族的粘附分子来介导。除β2组外,integrin分子识别的配体大都是细胞外基质的成分,包括FN(fibronectin,纤粘连蛋白)、LM(lamnin,层粘连蛋白)、VN(Vitronecin,玻璃粘连蛋白)、CA(collagen,胶原蛋白)等。integrin分子广泛表达于各种组织细胞,而其配体广泛存在于细胞外基质中。细胞与基质的附着主要有以下两种情况:(1)间叶细胞,以成纤维细胞为代表,细胞的周围均与细胞外基质附着;(2)上皮细胞,细胞的周围部分与细胞外基质附着,而细胞侧面则是细胞之间的附着,在这种情况下细胞粘附分子的分布存在着极性,细胞癌变过程往往伴随着这种极性的丧失。
粘附分子参与细胞的移动
在细胞发育、分化以及创伤修复过程中都需要细胞的移动,迄今为止对这一过程的确切机制还没有明确的认识,但可以肯定的是细胞粘附分子是这一过程的重要参与者,而且这些粘附分子的表达得到精细的调控。已经发现E-Cadherin、N-Cadherin、NCAM,CD31及FN和FN受体都与细胞移动有关。(1)在胚胎发育过程中,视神经轴突要沿着视束生长到达中脑顶盖建立突触联系,处于生长状态的轴突在神经表皮细胞表面移动,两者均表达N-Cadherin分子。如将胚胎的视网膜组织种植在单层不表达N-Cadherin的Neuro2a细胞上,神经轴突不能生长;如果将Neuro2a细胞转染N-Cadherin分子,则可以看到神经轴突的生长;抗N-Cadherin分子的抗体可以抑制轴突的生长。(2)FN及其受体的相互作用同样参与了胚胎发育中细胞的移动过程,含有RGD序列的多肽可以干扰胚胎发育中器官的发生。此外,FN及其受体还参与创伤修复过程中细胞的移动,FN可促进创面的愈合。(3)CD31则对细胞的移动具有抑制作用。
细胞粘附分子对细胞的移动具有促进与抑制两种作用,粘附分子在细胞表面分布的极性可能与其作用的差异有关。如CD31和E-Cadherin都分布在细胞的侧面与邻近细胞接触的部位,它们对细胞的移动具有抑制作用。
与肿瘤关系
浸润与转移
粘附分子与肿瘤的的关系主要包括对肿瘤浸润和转移的影响,对杀伤细胞杀伤肿瘤的影响,以及辅助肿瘤的诊断。
恶性肿瘤一个重要生物学特征是其对邻近正常组织的浸润及远处转移。目前已知肿瘤的浸润与转移与其粘附分子表达的改变有关。一方面肿瘤细胞某些粘附分子表达的减少可以使细胞间的附着减弱,肿瘤细胞脱离与周围细胞的附着,这是肿瘤浸润及转移的第一步;另一方面,肿瘤细胞表达的某些粘附分子使已入血的肿瘤细胞得以粘附血管内皮细胞,造成血行转移。
1.E-Cadherin与肿瘤浸润的关系 包括大肠癌、乳腺癌等在内的多种肿瘤细胞E-Cadherin分子表达明显减少或缺失,E-Cadherin分子表达水平降低与肿瘤细胞恶性程度显著相关。E-Cadherin分子在恶性程度低的乳腺癌细胞的表达水平明显高于恶性程度高的肿瘤细胞,而且其表达水平与腺小管形成成正比。体外实验更明确地证实了E-Cadherin分子与肿瘤浸润能力的关系。在培养状态下表达E-Cadherin分子的肿瘤细胞不侵入基附着的基质,但如加入抗E-Cadherin分子的抗体,则肿瘤细胞获得浸润能力;不表达E-Cadherin分子的肿瘤细胞在培养时表现浸润能力,但如将E-Cadherin分子的cD-NA转染肿瘤细胞使其表达E-Cadherin分子后,则肿瘤细胞丧失其浸润能力。
肿瘤细胞除粘附分子表达水平改变外,粘附分子在其表面的分布往往也有改变。E-Cadherin分子在正常的上皮组织中只分布于细胞相邻的侧面。而在某些上皮组织起源的肿瘤细胞E-Cadherin分子可以表达在细胞顶部。尽管某些肿瘤细胞可以表达一定水平的E-Cadherin分子,但分布的异常使其难以发挥细胞间附着的作用,这也可能与肿瘤的浸润与转移有关。
2.integrin家族与肿瘤浸润和转移的关系 integrin家族粘附分子在肿瘤细胞的表达水平也明显改变,既可表达数量减少或缺失,也可以表达升高,分布在极性亦可能不同于正常细胞。integrin分子在肿瘤细胞表达变化的不一致性可能与integrin分子的不同作用有关。同一种粘附分子可以在转移和附着两个不同的过程中发挥作用,因此integrin分子表达的增加或减少都可能与肿瘤细胞浸润及转移有关。
3.CD44和其它粘附分子对肿瘤转移的影响 与E-Cadherin分子对肿瘤浸润与转移的抑制作用相反,肿瘤细胞表达的某些粘附分子作为血管内皮细胞表面粘附分子、细胞外基质的相应受体可使已进入血流的肿瘤细胞粘附血管内皮细胞或基质,促进肿瘤细胞的转移。对肿瘤血行转移的研究多采用小鼠尾静脉注射黑素瘤细胞造成肺转移的模型,已知黑素瘤细胞表达的CD44分子、层粘连蛋白受体等都可以促进黑素瘤细胞有肺部形成转移灶,用相应粘附分子的抗体或可溶性配体则可减少黑素瘤的肺部形成转移灶。此外体内慢性炎症部位往往是肿瘤转移灶的好发部位,可能与炎症产物、细胞因子作用于局部血管内皮细胞促进其粘附分子表达而有利于肿瘤细胞的粘附有关。
杀伤影响
杀伤细胞与肿瘤细胞的接触由两种细胞表面粘附分子的相互作用来介导,LFA-1/ICAM-1的相互作用具有重要地位。多种肿瘤细胞表达ICAM-1分子,肿瘤细胞ICAM-1分子的表达可能与肿瘤组织内淋巴细胞的浸润有关。细胞因子如IFN-γ、IFN-α、IL-4、TNF-α可促进某些肿瘤细胞ICAM-1分子的表达,从而增加其对杀伤细胞作用的敏感性。毛细胞白血病细胞不表达LFA-1和ICAM-1分子,使其对CTL的杀伤作用更为敏感。肿瘤患者血清中可溶性ICAM-1水平往往高于正常人,可能抑制NK对肿瘤细胞的杀伤作用。
诊断
不同integrin分子在不同的组织、细胞有其特定的分布方式,虽然在肿瘤组织integrin分子的表达不同于正常组织,但仍在一定程度上保留了这种特定的分布方式,从而可以作为肿瘤分型诊断的参考依据。由于分化程度低的恶性肿瘤细胞在组织学上难以区分其组织来源,因此对其integrin分子表达的检测可以作为肿瘤诊断的一个有效的辅助手段。
与凝血关系
与动脉凝血
细胞粘附分子(图1)
动脉中形成的血栓主要由血小板组成,称为白血栓。动脉中血栓的形成过程包括最初血小板与血管壁损伤部位的接触、粘附及随后的活化、伸展和聚集。血小板与血管壁损伤部位的接触由血小板表面糖蛋白复合物GPIb-IX与管壁上的vWF因子(vonWillebrandfacfor)的结合介导。GPIb-IX或vWF的遗传缺陷都可以导致病人凝血机能的障碍,在临床上分别被称为Bernard-Soulier综合征(Bernard-Souliersyndrome,BSs)和vonWillebrand病(vonWillebrand'sdisease,vWd)。
GPIb由一两条多肽链通过二硫键连接所组成,两条链分别称为GPIba(135kDa,CD42b)和GPIbβ(22kDa,CD42c),GPIb与另一个糖蛋白分子GPIX(23kDa,CD42a)按1:1的比例通过非共价键结合构成GPIb-IX复合物。GPIbα、GPIbβ和GPIX的共同特点是都含有不同数目的由24个氨a基酸构成的富含亮氨酸糖蛋白的重复序列段(leucine-rechglycoprotein,LRG)。BSs病人的血小板除缺乏GPIbα、GPIbβ、GPIX三种分子外,同时还缺乏另一条称为GPV的肽链。GPV同样含有LRG序列,其功能还不清楚。GPIb-IX复合物与vWF结合的部位在GPIbα链上,位于其N端的第7个LRG重复序列及近膜部分的富含碳水化合物区域之间。vWF可由血管内皮细胞和血小板合成,单体分子量为220kDa。血管内皮细胞可向其附着面分泌vWF,结合于基底膜的胶原纤维。
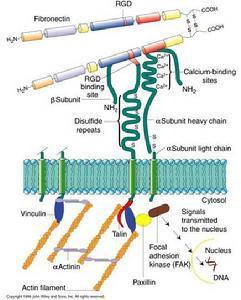
细胞粘附分子(图2)
GPIb-IX与vWF的结合导致血小板的活化,使血小板糖蛋白GPⅡb-Ⅲa(αⅡbβ3)的构型发生改变,得以与血浆中vWF、FB、FN等配体结合,构成后续血小板的结合部位,触发血小板的聚集过程。另一种血小板糖蛋白GPⅠaⅡa(α2β1)可能也参与此过程。
与静脉凝血
静脉血栓形成过程中血小板起着较为次要的作用,血栓主要含有红细胞和纤维蛋白,称为红血栓,此过程与GPIb-IX和vWF的相互作用无关。血小板与血管壁的粘附可能由GPIaⅡa(α2β1)、GPIcⅡa(α5β1)αvβ3、GPⅡbⅢa(αⅡbβ3)等粘附分子共同介导,上述粘附分子的作用是切力非依赖性的。
与细胞信号
粘附分子与细胞内酪氨酸磷酸化
细胞间或细胞-基质间粘附分子相互作用并不仅限于细胞的粘附和附着,对参与粘附细胞的活化、分化、生长和分泌等也有显着的影响,并有赖于粘附分子将胞外粘附分子相互作用的信号向细胞内的传导。粘附分子所传导的信号可能作为一种辅助因素,协同其它刺激因素的作用,如α3β1、α4β1、α5β1、α6β1和αLβ2与配体的作用可以协同TCR/CD3介导的淋巴细胞增殖和细胞因子产生,提示淋巴细胞与胞外基质的作用可能影响其活化状态。此外单核细胞及中性粒细胞表面integrin分子与配体的作用也参与诱导细胞产生炎症因子的过程。
酪氨酸磷酸化是细胞内信号传导的一个重要途径,而integrin分子与某些细胞内的酪氨酸磷酸化发生有关。血小板活化过程伴随着广泛的细胞内蛋白酪氨酸磷酸化,integrin分子αⅡbβ3的表达是血小板内酪氨酸磷酸化过程发生的必要条件,αⅡbβ3不表达或其与配体的作用被阻断均可阻碍血小板内的酪氨酸磷酸化过程。但αⅡbβ3单独作用并不足以引起酪氨酸磷酸化,而只是作为其它刺激活化因素的必要辅助条件。对其它细胞进行的研究结果同样提示integrin分子参与细胞内酪氨酸磷酸化的过程,如使KB细胞(一种癌细胞系)表达的α3β1分子发生交联后可以发现细胞内一种分子量为115-130kDa的分子发生酪氨酸磷酸化;NIH3T3细胞粘附干纤粘蛋白分子或用抗integrin抗体刺激,可以导致细胞内一种蛋白发生酪氨磷酸化。
某些细胞(如成纤维细胞、内皮细胞)粘附于纤粘连蛋白后胞浆的pH值升高。胞浆中pH值升高是integin分子与配体作用后向细胞内传导信号的结果,与细胞的伸展和生长有关。
一种称之为白细胞应答整合素的integrin分子(leukocyteresponseintegrin,LRI),与integrinβ3存在交叉反应,但不同于已知的任何一种integrin分子。LRI介导的吞噬增强作用可被蛋白激酶C抑制剂H7和Staruosporin所阻断,也可被百日咳毒素、钙离子螯合剂MAPTAM及结合磷脂酰肌醇的新霉素所抑制,因此推测LPI与配体的作用可能引起G-蛋白依赖的磷脂酶C的活化,导致细胞内PKC的活化和Ca2 浓度升高。此外还发现一种与LPI共沉淀的被称作整合素相关蛋白(integrinassociatedproteinIAP)的5kDa分子,可能属于一种多次跨膜细胞表面分子家族。抗IAP的抗体可以抑制LRI介导的吞噬增强作用,推测IAP可能与LRI结合配体的亲和力有关或参与LPI的信号传导过程。


