氢氧化镁(一种弱碱性物质)

VLoG
次浏览
更新时间:2023-05-19
氢氧化镁
一种弱碱性物质

氢氧化镁(Magnesium Hydroxide)是一种弱碱,为无机物,又名镁乳,化学式为Mg(OH)₂。氢氧化镁可以矿物形式存在于自然界中,即水镁石(Brucite)。氢氧化镁外观呈白色片状结晶或粉末,微溶于水,不溶于醇,溶于酸和铵盐溶液,其分子量为58.327,密度为2.36 g/cm³。氢氧化镁受热分解为氧化镁和水,水解生成镁离子和氢氧根离子,可与二氧化碳、酸、铵盐等物质反应。
基本信息
中文名
氢氧化镁
英文名
Magnesium Hydroxide, Milk of magnesia
别名
镁乳
CAS号
1309-42-8
性质
化学式
Mg(OH)₂
结构式

摩尔质量
58.327 g/mol
外观
白色片状结晶或粉末
密度
2.36 g/cm³
熔点
350 ℃
溶解性
微溶于水,不溶于醇,溶于酸和铵盐溶液
氢氧化镁可在医药领域作制药原料,用于治疗便秘、胃肠道疾病等;在高分子领域作阻燃剂、分散剂,用于聚合物的填充及聚合;在环境治理领域用于废水处理、烟气脱硫;在建筑领域用于掺杂水泥,提高其碳化程度及抗压强度;还可在农业中作肥料,在分析化学中作分析试剂,在化工生产中作化工原料等。氢氧化镁基本无毒,但其粉尘对黏膜及眼结膜有轻度刺激作用。
历史
1818年,美国发明家约翰·考伦(John Callen)首次获得化合物氢氧化镁的专利,专利号为X2952。1829年,詹姆斯·默里爵士(Sir James Murray)首次将液态氢氧化镁的浓缩溶液用于治疗爱尔兰贵族的胃痛并取得了成功。1872年,查尔斯·亨利·菲利普斯(Charles Henry Phillips)发明了出了氢氧化镁的悬浮液,并将其命名为“镁乳(milk of magnesia)”,随后菲利普斯牌镁乳便开始出售用于药用。
来源与分布
氢氧化镁可以矿物形式存在于自然界中,即水镁石(Brucite)。于1824年由法国矿物学家弗朗索瓦·叙尔皮斯·伯当(François Sulpice Beudant)命名,以纪念其发现者——美国矿物学家阿奇博尔德·布鲁斯(Archibald Bruce)。
水镁石是低温热液矿脉矿物,多赋存在富含镁质的变质岩中,如蛇纹石、绿泥石片岩或白云石片岩内。共生矿物有方解石、金云母、透闪石、霰石、滑石及菱镁矿等。水镁石矿床类型有3种,即菱镁矿热液蚀变型水镁石矿床、镁质碳酸盐岩热液蚀变型水镁石矿床、镁质碳酸盐岩区域变质型水镁石矿床。水镁石资源主要分布在美国内华达州、亚利桑那州,朝鲜北部和俄罗斯。英国、爱尔兰和加拿大等地也有水镁石资源。中国已在辽宁凤城、宽甸、营口,黑龙江牡丹江,吉林集安,河南西峡,江苏六合,陕南黑木林等地找到一些水镁石矿床。

水镁石(氢氧化镁)

阿奇博尔德·布鲁斯(1777-1818)
物质结构
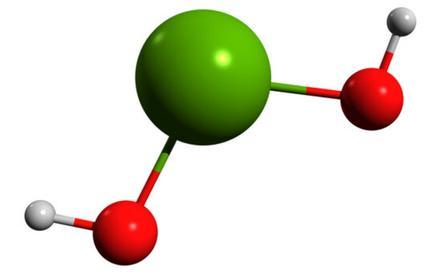
氢氧化镁球棍模型
氢氧化镁晶体属六方晶系,p3 m1空间群,在氢氧化镁晶体中,Mg与六个等效的OH连接构成[Mg-(OH)₆]⁴⁻八面体,Mg位于八面体中心,OH位于八面体的顶点,八面体按一定规律排列构成氢氧化镁晶体。[Mg-(OH)₆]⁴⁻的堆积形成有两种形式,第一种是O-Mg-O夹角为120°的堆积,第二种是O-Mg-O夹角为60°的堆积,其过程如下图所示。两种[Mg-(OH)₆]⁴⁻再排列组合为氢氧化镁晶体,晶体结构如下图所示:
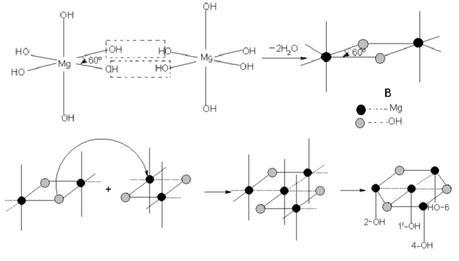
[Mg-(OH)₆]⁴⁻的第一种堆积
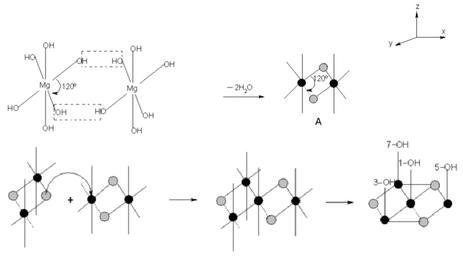
[Mg-(OH)₆]⁴⁻的第二种堆积
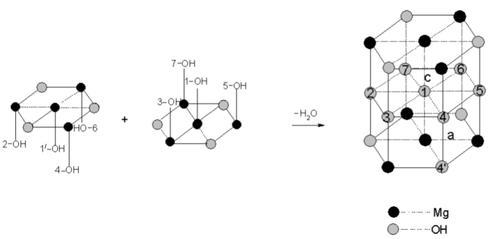
氢氧化镁晶体的堆积
理化性质
物理性质
氢氧化镁外观呈白色片状结晶或粉末,微溶于水,不溶于醇,溶于酸和铵盐溶液,其在水中的溶解度为9 mg/L(18 ℃)。氢氧化镁分子量为58.327,密度为2.36 g/cm³,熔点为350 ℃,折射率为1.559,莫氏硬度为2.5,溶度积为1.2×10⁻¹¹。
化学性质
氢氧化镁受热可分解为氧化镁和水,水解生成镁离子和氢氧根离子,溶液呈弱碱性。氢氧化镁可与盐酸、碳酸和氟硅酸等酸反应,生成相应的镁盐和水;可与不同量的铵盐反应,生成相应的镁盐和氨水。此外还可与二氧化碳、碳酸钠等物质反应。
热分解
氢氧化镁受热至340℃左右时开始吸热脱水,分解生成氧化镁,430℃到达顶峰,490℃分解完毕。反应方程式如下:

水解
氢氧化镁水解生成镁离子和氢氧根离子,呈弱碱性。反应方程式如下:

与二氧化碳反应

与酸反应




与铵盐反应



与碳酸钠反应

制备方法
实验室制法

氢氧化镁也可通过金属镁与沸水反应制得。反应方程式如下:

工业制法
水镁石研磨法
氢氧化镁可由水镁石研磨制得。以矿物形式的氢氧化镁(水镁石)为原料,通过精选、微粉碎、湿法超细磨及表面活化处理等工序即可制得氢氧化镁成品。
白云石煅烧法
氢氧化镁可由白云石煅烧制得。将白云石煅烧后,可生成氧化钙和氧化镁,然后将其水化生成氢氧化钙和氢氧化镁石灰乳。在石灰乳中加入一定量的氯化镁,使氢氧化钙也转化为氢氧化镁,即得氢氧化镁成品。反应原理与流程图如下:



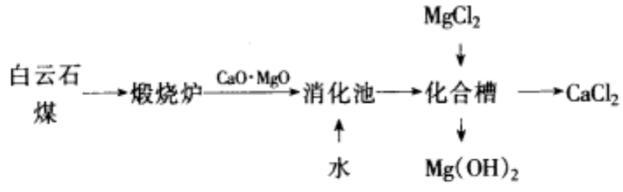
煅烧法制氢氧化镁工艺流程图
卤水﹣石灰法
氢氧化镁可由卤水与石灰反应制得。将卤水过滤、脱硫,石灰经消化除渣后制成石灰乳后,将卤水与石灰乳于反应槽内进行沉淀反应,得到的料浆进行澄清、过滤、洗涤、干燥和粉碎,即制得氢氧化镁成品。反应原理与流程图如下:

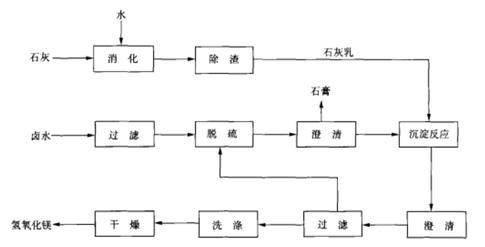
卤水-石灰法制氢氧化镁工艺流程图
卤水﹣氨水法
氢氧化镁可由卤水与氨水反应制得。将卤水净化处理除去硫酸盐、二氧化碳及少量硼等杂质,以氨水作为沉淀剂在反应器中进行沉淀反应,在反应前投入一定量的晶种,进行充分搅拌。反应完成后添加絮凝剂,沉淀物经过滤、洗涤、烘干及粉碎,即得氢氧化镁成品。反应原理与流程图如下:

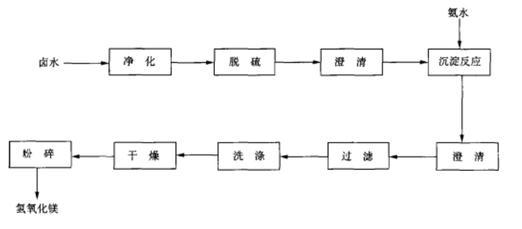
卤水-氨水法制氢氧化镁工艺流程图
菱苦土﹣盐酸﹣氨水法
氢氧化镁可由菱苦土与盐酸和氨水反应制得。将菱镁矿石与无烟煤或焦炭在竖窑内煅烧,生成氧化镁和二氧化碳。苦土粉用水调成浆状后与盐酸反应制备氯化镁溶液,氯化镁再与一定浓度的氨水在反应器中进行反应,生成物经洗涤、沉降、过滤分离、干燥及粉碎,即得氢氧化镁成品。反应原理与流程图如下:


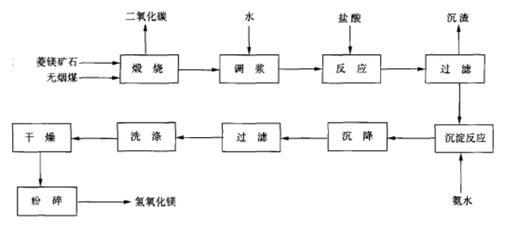
菱苦土﹣盐酸﹣氨水法制氢氧化镁工艺流程图
硼泥酸浸法
氢氧化镁可由硼泥酸浸制得。硼泥是硼酸、硼砂生产过程中形成的固体废弃物,将其转化为氢氧化镁可避免其对环境造成污染。将硼泥与工业硫酸的混合泥浆在高温炉中煅烧一定时间,取出后加水溶解、加热、过滤,得到母液。母液经过滤、除杂,得到镁精液,再经过滤、洗涤及烘干,即得氢氧化镁成品。流程图如下:
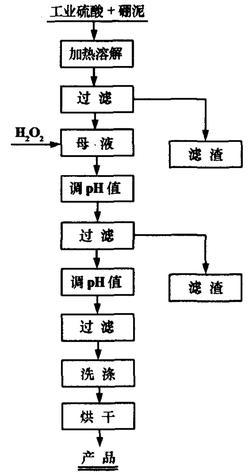
硼泥酸浸法制氢氧化镁工艺流程图
海水提取法
氢氧化镁可由海水提取制得。海水中镁离子含量丰富,平均浓度约为1300mg/L,所以可以海水为原料制备氢氧化镁。将海水经精制处理、合成反应、沉降增稠、洗涤、过滤、轻烧、重烧等过程即可制得氢氧化镁。在沉淀氢氧化镁时,可先加入一部分氢氧化镁或者氧化镁作为晶种,使其沉淀颗粒变大,易于沉降和过滤。
检测方法
滴定法
EDTA滴定
氢氧化钠滴定
将样品用硫酸溶解后,滴加加甲基红指示剂,用氢氧化钠滴定过量的盐酸。计算得氢氧化镁含量。
应用领域
医药领域
氢氧化镁可用于医药领域。氢氧化镁可作渗透性泻药,用于治疗习惯性便秘及高龄、体弱者的便秘。也可作抗酸剂,用于治疗胃酸过多、胃炎及十二指肠溃疡等,如胃药达喜即以氢氧化镁为原料制成。氢氧化镁不可过量或长期服用,过量服用会导致脱水、腹泻,肾功能不全者长期服用会引起高镁血症,严重时可发生低血压、呼吸抑制等症状。氢氧化镁与氟喳诺酮类药物、四环素类药物等同服,可减低它们的抗菌活性;与抗胆碱药物合用可加速溃疡愈合,提高疗效。氢氧化镁也可作兽药,用于治疗犬、猫、牛、马和羊等动物的胃肠道疾病。
高分子领域
阻燃剂
氢氧化镁可用作阻燃剂。经硅烷偶联剂、铝酸酯偶联剂、有机硅和阳离子表面活性剂等材料改性后的氢氧化镁可用作高聚物基复合材料的无机阻燃填料。添加氢氧化镁阻燃剂的聚合物在受热分解时释放出水分,吸收大量潜热,降低了材料表面的火焰温度及降解速度,减少了可燃气体的产生,分解过程中释放出的大量水蒸气可冲淡聚合物表面的氧气和可燃气体的浓度,使表面燃烧较难进行,且氢氧化镁有利于形成表面炭化层,阻止氧气和热量的进入,其分解生成的氧化镁是良好的耐火材料,能提高聚合物材料抵抗火焰的能力,起到隔绝空气阻止燃烧的作用。具有无毒、低烟及分解后生成的氧化镁化学性质稳定、不产生二次污染等特点。 添加氢氧化镁后,可使合成材料承受更高的加工温度,利于加快挤塑速度,缩短模塑时间,且氢氧化镁粒径细,对设备磨损小,利于加工设备的使用寿命。可广泛用于聚丙烯、聚乙烯、聚氯乙烯、高抗冲击聚苯乙烯和ABS等塑料、橡胶行业。
分散剂
环境治理领域
废水处理
氢氧化镁可用于酸性废水、染料废水及含重金属废水的处理。氢氧化镁具有弱碱性,处理酸性废水时,其反应过程平缓,具有缓冲性,处理后的pH值不会超过9。处理染料废水时,可由镁盐加碱生成带正电荷的氢氧化镁,吸附带负酸性废水电荷的阴离子染料,亦或直接使用氢氧化镁,均可获得良好的脱色效果。氢氧化镁处理含铬废水时,先在酸性条件下用硫酸亚铁将铬离子还原,然后加入氢氧化镁乳液使其形成氢氧化物沉淀而除去。除直接使用氢氧化镁外,也可将其制成一定厚度的过滤床层填充在过滤柱中,当含重金属离子的废水流过时,就被吸附在氢氧化镁表面从而去除。
烟气脱硫
氢氧化镁可用于烟气脱硫,处理化工生产中排放的二氧化硫气体。用含氢氧化镁的浆液吸收二氧化硫,可将其转化为Mg(HSO₃)₂、MgSO₃,再经空气氧化为MgSO₄,反应原理如下。采用氢氧化镁脱硫,具有设备简单,运行费用低;原料无毒无腐蚀,来源稳定等特点。






建筑领域
氢氧化镁可用于建筑领域。可将氢氧化镁以掺合料的形式填充于水泥中,提高水泥的碳化和抗压强度。水泥经碳化后,硬化浆体中的氢氧化镁与二氧化碳反应生成碳酸镁,堵塞水泥石中的孔隙,提高水泥石的密实度,从而使碳化水泥石强度提高,且随着碳化龄期的延长,碳化反应生成的碳酸镁增多,水泥石更加密实,碳化后的强度更高。 也可将氢氧化镁掺杂到过期复合硅酸盐水泥等中,氢氧化镁部分溶于水时完全电离为镁离子和氢氧根离子,可在水泥中充当惰性骨料并碱激发水泥的水化反应,填充其密实结构并提高其抗压强度,为过期水泥的再利用提供了可行性。
农业领域
氢氧化镁可于农业领域,其作为农用镁肥具有含镁量高、肥效稳长、不易淋失的优点,适宜于缺镁的酸性土壤或微酸性土壤施用。氢氧化镁还可与磷酸等物质混用,作堆肥过程中的保氮固定剂。纳米级氢氧化镁可作农药,可用于处理茶叶黑斑病、芒果叶斑病等,其对大肠杆菌、金黄色葡萄球菌、枯草芽孢杆菌及苏云金芽孢杆菌等都具有显著的抗菌活性,是一种优良的抗菌材料。
分析化学领域
氢氧化镁可用作分析试剂,用于其他化学物质的检测分析。采用氢氧化镁共沉法可以测定水中的镉、铅等元素,氢氧化镁可将水样中的微量元素浓缩近10倍,降低了最低检测浓度。
化工领域
氢氧化镁可用作化工原料,用于制造氧化镁、碳酸镁及碳酸氢镁等镁盐,还可用于生产除臭剂等商品。
安全事宜
毒性
氢氧化镁基本无毒,但其粉尘对黏膜及眼结膜有轻度刺激作用。氢氧化镁的毒性来源于镁离子,过量服用氢氧化镁药品可引起低血压、恶心及呕吐等症状,严重时可致肠道穿孔、呼吸抑制、中枢神经系统抑制等。此外,氢氧化镁可以通过抑制结肠上皮细胞的过度增生来防止化学诱导的肠癌发生。
储存与贮运
氢氧化镁应贮存于阴凉、通风、干燥的库房中,严格防潮、防水,远离火种、热源。严禁与酸类物品共贮混运。搬运时轻装轻卸,防止包装破损。


