过氧化氢酶(催化过氧化氢分解成氧和水的酶)

VLoG
次浏览
更新时间:2023-05-22
过氧化氢酶
催化过氧化氢分解成氧和水的酶
简介
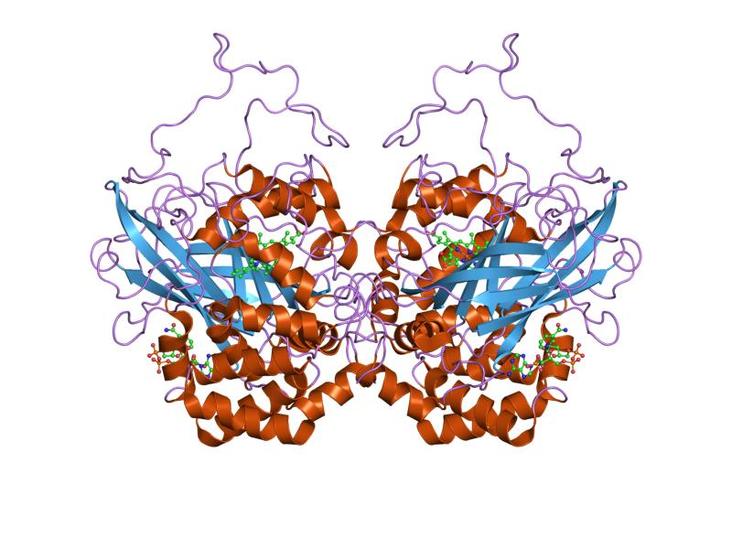
过氧化氢(H2O2)即人们熟知的双氧水,比水(H2O)多了一个氧原子(0),这个氧原子极不稳定,总想从别的物质分子中再夺取一个氧原子,形成O2。平时我们用双氧水杀菌消毒,就是因为细菌遭到H2O2的破坏而死亡,消毒时起泡是产生氧气的结果。然而,过氧化氢可穿透大部分细胞膜,因此它比超氧阴离子自由基(不能穿透细胞膜)具有更强的细胞毒性,穿透细胞膜后可与细胞内的铁发生反应生成羟基自由基。过氧化氢酶(CAT)是抗氧化酵素系统的重要一员,又被称为触酶,是以铁卟啉为辅基的结合酶。SOD酵素将氧自由基歧化后生成过氧化氢(H2O2)和氧气(O2),过氧化氢在体内仍然是具有氧化剂毒性的物质,过氧化氢酶的作用就是促使过氧化氢分解为分子氧和水,使细胞免于遭受H2O2的毒害。CAT作用于过氧化氢的机理实质上是过氧化氢的岐化,必须有两个H2O2分子先后与CAT相遇且碰撞在活性中心上,才能发生反应。H2O2浓度越高,分解速度越快几乎所有的生理机体,都存在过氧化氢酶。其普遍存在于能呼吸的生物体内,主要存在于植物的叶绿体、线粒体、内质网以及动物的肝和红细胞中其酶促活性为机体提供了抗氧化防御机理。过氧化氢酶的生物功能是在细胞中促进过氧化氢分解,使其不会进一步产生毒性很大的氢氧自由基,从而保护抗氧化酵素系统的功能作用,对于人体的生长发育和代谢活动亦具有重要意义。
阎世英编著,酵素决定健康,中国医药科技出版社,2015.12
过氧化氢酶的作用是使过氧化氢还原成水: 2H2O2=O2↑+ 2H2O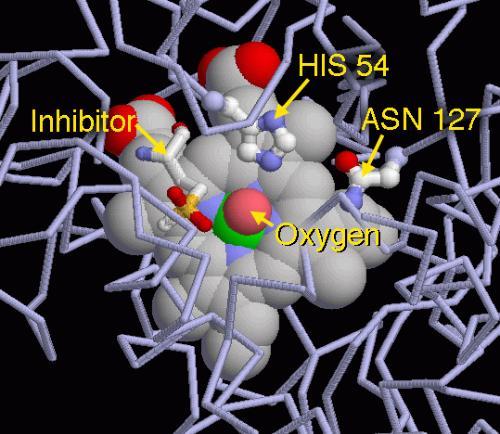

过氧化氢酶
中文名称:过氧化氢酶
英文别名:Fungal catalase; catalase from bovine liver; catalase F. bov. liv.,cryst.susp. in H2O; Catalase from microorganisms; catalse from bovine liver; catalase from human erythrocytes; catalase from dog liver; catalase from mouse liver; catalase from bison liver; Catalase (bovine liver); Catalase, Human Erythrocytes; Catalase Aspergillus niger; Catalase from Corynebacterium glutamicum; Catalase Micrococcus lysodeikticus; Catalase
CAS:9001-05-2

过氧化氢酶
EINECS:232-577-1
EC 1.11.1.6
触酶
过氧化氢酶(CAT)是一种酶类清除剂,又称为触酶,是以铁卟啉为辅基的结合酶。它可促使H2O2分解为分子氧和水,清除体内的过氧化氢,从而使细胞免于遭受H2O2的毒害,是生物防御体系的关键酶之一。CAT作用于过氧化氢的机理实质上是H2O2的歧化,必须有两个H2O2先后与CAT相遇且碰撞在活性中心上,才能发生反应。H2O2浓度越高,分解速度越快。
分解酶
这是一种稳定的过氧化氢分解酶,能将过氧化氢分解成水和氧气,而对纤维和染料没有影响,因而漂白后染色前,通过H2O2 分解酶去除漂白织物上和染缸中残留的过氧化氢,以避免纤维的进一步氧化和染色时染料的氧化。同时能缩短加工时间,减少水洗用水,降低废水量。尤其对纱线、筒子纱和针织物更为适用。同样,过氧化氢分解酶随pH 值和温度的改变,其活力随之变化,在pH7 左右和30~40 ℃活性最大。过氧化氢浓度增大,会加快分解反应速度,但必须注意当浓度大于一定量时,酶的作用将减弱,这样过多地残留H2O2 对纤维和染料是不利的。所以不能因为有了H2O2 分解酶,就能任意地加大H2O2 的用量。使用时,通常要注意H2O2 分解酶对常用表面活性剂和H2O2 稳定剂的相容性,实际生产应用pH为6~8,温度20~55 ℃,每用量5~10KCLU/ 升,时间10~20min。此技术已慢慢地被国内所认识和接受,它对提高活性染料色泽鲜艳度很有利。
来源
几乎所有的生物机体都存在过氧化氢酶。其普遍存在于能呼吸的生物体内,主要存在于植物的叶绿体、线粒体、内质网、动物的肝和红细胞中,其酶促活性为机体提供了抗氧化防御机理。
CAT是红血素酶,不同的来源有不同的结构。在不同的组织中其活性水平高低不同。过氧化氢在肝脏中分解速度比在脑或心脏等器官快,就是因为肝中的CAT含量水平高。
反应机制
虽然过氧化氢酶完整的催化机制还没有完全被了解,但其催化过程被认为分为两步:
H2O2 + Fe(III)-E → H2O + O=Fe(IV)-E(.+)
H2O2 + O=Fe(IV)-E(.+) → H2O + Fe(III)-E + O2[12]
其中,“Fe()-E”表示结合在酶上的血红素基团(E)的中心铁原子(Fe)。Fe(IV)-E(.+)为Fe(V)-E的一种共振形式,即铁原子并没有完全氧化到+V价,而是从血红素上接受了一些“支持电子”。因而,反应式中的血红素也就表示为自由基阳离子(.+).
过氧化氢进入活性位点并与酶147位上的天冬酰胺残基(Asn147)和74位上的组氨酸残基(His74)相互作用,使得一个质子在氧原子间互相传递。自由的氧原子配位结合,生成水分子和Fe(IV)=O。Fe(IV)=O与第二个过氧化氢分子反应重新形成Fe(III)-E,并生成水分子和氧气。[12]活性中心铁原子的反应活性可能由于357位上酪氨酸残基(Tyr357)的苯酚基侧链的存在(帮助Fe(III)氧化为Fe(IV))而得以提高。反应的效率可能是通过His74和Asn147与反应中间体作用而得以提高。[12]该反应的速率通常可以通过米氏方程来确定。[2]
H2O2 + H2R → 2H2O + R
同样,具体的反应机制还不清楚。
处于过氧化状态的过氧化氢酶中间体的三维结构已经获得解析,可以在蛋白质数据库中检索到。
检测
进行中的过氧化氢酶检测,可以观察到气泡。
过氧化氢酶检测是微生物学家鉴定细菌种类的主要的三种检测手段之一,即用过氧化氢来检测过氧化氢酶是否存在。假如细菌中含有过氧化氢酶,则在过氧化氢溶液中加入少量细菌提取物就能观察到氧气气泡生成。
有气泡生成,则该菌被认为是呈“过氧化氢酶阳性”。如staphylococcus和micrococcus。没有,则该菌被认为是呈“过氧化氢酶阴性”。如streptococcus和enterococcus。虽然过氧化氢酶检测无法鉴定特定生物体,但与其他检测方法结合,它可以有效地帮助诊断。
此外细菌中是否存在过氧化氢酶,还取决于细胞生长条件和所使用的培养基。
分布
应用
功能
功能概述
过氧化氢是一种代谢过程中产生的废物,它能够对机体造成损害。为了避免这种损害,过氧化氢必须被快速地转化为其他无害或毒性较小的物质。而过氧化氢酶就是常常被细胞用来催化过氧化氢分解的工具。
但过氧化氢酶真正的生物学重要性并不是如此简单:研究者发现基因工程改造后的过氧化氢酶缺失的小鼠依然为正常表现型,这就表明过氧化氢酶只是在一些特定条件下才对动物是必不可少的。
历史
疾病
过氧化物酶体异常(peroxisomal disorder)过氧化物酶缺乏症(acatalasia)是由过氧化氢酶功能缺陷所造成的。


