组蛋白(德国A.科塞尔发现的蛋白质)

VLoG
次浏览
更新时间:2023-05-22
组蛋白
本词条是多义词,共2个义项
德国A.科塞尔发现的蛋白质
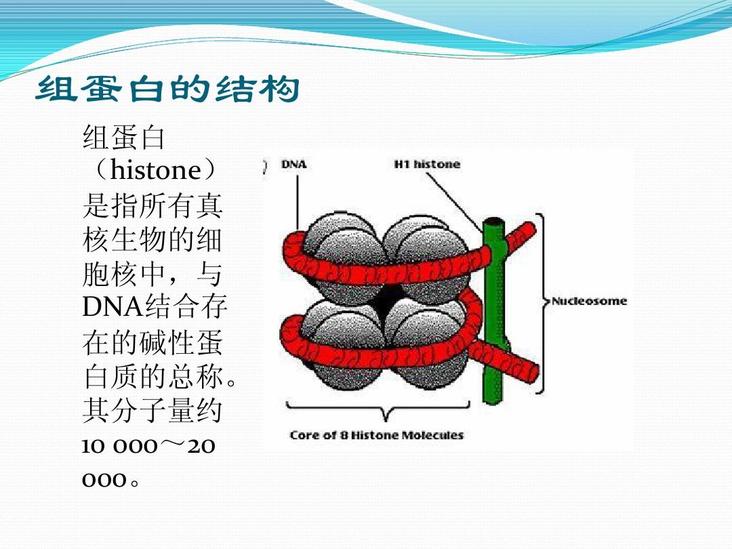
基本信息
| 中文名 | 组蛋白 |
| 外文名 | histones |
| 分子量 | 10000~20000 |
| 成分 | 精氨酸和赖氨酸等 |
| 存在 | 真核生物的细胞核中 |
| 本质 | 与DNA结合存在的碱性蛋白质总称 |
收起
简介

组蛋白图片
亲缘关系较远的种属中,四种组蛋白(H2A、H2A、H3、H4)氨基酸序列都非常相似,如海胆组织H3的氨基酸序列与来自小牛胸腺的H3的氨基酸序列间只有一个氨基酸的差异,小牛胸腺的H3的氨基酸序列与豌豆的H3也只有4个氨基酸不同。不同生物的H1序列变化较大,在某些组织中,H1被特殊的组蛋白所取代。如成熟的鱼类和鸟类的红细胞中H1则被H5所取代,精细胞中则由精蛋白代替组蛋白。染色质中的组蛋白与DNA的含量之比为1:1。
真核生物细胞核中组蛋白的含量约为每克DNA1克,大部分真核生物中有5种组蛋白,两栖类、鱼类和鸟类还有H5以替代或补充H1。
真核生物体细胞染色质中的碱性蛋白质,含精氨酸和赖氨酸等碱性氨基酸特别多,二者加起来约为所有氨基酸残基的1/4。组蛋白与带负电荷的双螺旋DNA结合成DNA-组蛋白复合物。因氨基酸成分和分子量不同,主要分成5类。
研究历史
组蛋白于1834年由德国科学家A.科塞尔发现。早在1888年德国化学家科塞(A.Kossel)已从细胞核中分离出组蛋白,并认识到它们作为碱性物质应在核中与核酸结合,但直到1974年才了解组蛋白的确切作用。一些实验室随后证明组蛋白以独特的方式构成核小体的组分。
组蛋白是已知蛋白质中最保守的,例如,人类和豌豆的H4氨基酸序列只有两个不同,人类和酵母的H4氨基酸序列也只有8个不同,这说明H4的氨基酸序列在约109年间几乎是恒定的。
直至1990年代早期,组蛋白才被更多认识,并非纯粹细胞核的惰性填充料,这部分基于马克·普塔什尼(Mark Ptashne)等人的模型,他们认为转录是被蛋白质-DNA和蛋白质-蛋白质相互作用在很大程度上被激活裸DNA模板,就像细菌一样。及后它的调控功能才被发现。
结构

组蛋白修饰与基因转录
组蛋白是存在于染色体内的与DNA结合的碱性蛋白质,染色体中组蛋白以外的蛋白质成分称非组蛋组蛋白白。绝大部分非组蛋白呈酸性,因此也称酸性蛋白质或剩余蛋白质。组蛋白于1834年由德国科学家A.科塞尔发现。组蛋白对染色体的结构起重要的作用。
通常含有H1,H2A,H2B,H3,H4等5种成分。除H1外,其他4种组蛋白均分别以二聚体(共八聚体)相结合,形成核小体核心。DNA便缠绕在核小体的核心上。而H1则与核小体间的DNA结合。因此,一般认为组蛋白作为结构支持体的作用比其基因调节作用更为重要。鸟类、两栖类等含有细胞核的红细胞中,含有一种叫H5的特殊组蛋白。此外,在停止增殖的细胞中,还含有一种叫H1°的组蛋白,H1°的结构与H5相类似。组蛋白可受到甲基化、乙酰化、磷酸化、聚ADP核糖酰化,以及与泛醌(ubiquinone)相结合等几种类型的修饰。组蛋白的修饰与染色质结构的变化及基因活性控制的相关性等等,是今后的重要研究课题。
种类 | 赖氨酸/精氨酸 | 残基数 | 分子质量(kd) | 保守性 | 存在部位及结构作用 |
H1 | 29.0 | 215 | 23.0 | 低 | 连接线上,锁定核小体、参与包装 |
H2A | 1.22 | 129 | 14.0 | 高 | 核心颗粒,形成核小体 |
H2B | 2.66 | 125 | 13.8 | 高 | 核心颗粒,形成核小体 |
H3 | 0.77 | 135 | 15.3 | 极高 | 核心颗粒,形成核小体 |
H4 | 0.79 | 102 | 11.3 | 极高 | 核心颗粒,形成核小体 |
H1富含碱性氨基酸
命名分类
几乎所有真核细胞染色体的组蛋白均可分成5种主要的组分,分别用字母或数字命名,命名方法也不统一,如H1或称F1,Ⅰ;H2A或称F2A2,Ⅱb1;H2B或称F2B,Ⅱb2;H3或称F3,Ⅲ;H4或称F2A1,Ⅳ。有核的红细胞或个别生物体中,还存在特别的组蛋白成分,红细胞中为H5或F2C,Ⅴ,鲑鱼组织中为H6或T。H2A、H2B、H3、H4组成核小体的核心,也称核心组蛋白。
根据组蛋白的一级结构,又可将它们分为3种类型:赖氨酸含量特别丰富的组蛋白(H1);赖氨酸含量较丰富的组蛋白(H2A和H2B);精氨酸含量丰富的组蛋白(H3和H4)。
先以组蛋白名称开始,如H3;单一字母的氨基酸简称,如K代表赖氨酸,及在蛋白质的位置;及修饰的种类,Me即甲基化、P即磷酸化、Ac即乙酰化及Ub即泛素化。
合成修饰
乙酰化
乙酰化有两种,一种是H1、H2A、H4组蛋白的氨基末端乙酰化,形成α-乙酰丝氨酸,组蛋白在细胞质内合成后输入细胞核之前发生这一修饰。二是在H2A、H2B、H3、H4的氨基末端区域的某些专一位置形成N6-乙酰赖氨酸。
ADP-核糖基化
其他修饰
赖氨酸的丙酰化、丁酰化、琥珀酰化、巴豆酰化、丙二酸酰等。
H3·H4的乙酰化可打开一个开放的染色质结构,增加基因的表达。转录共同激活物如CBPöP300、PCAF实质上是体内的组蛋白乙酰基转移酶(HAT)。相反,HDAC参与组成转录共同抑制复合物,已发现的两个共同抑制复合物SIN3、Mi22NHRD(核小体重塑蛋白去乙酰基酶)都含有HDAC1、HDAC2。SIN3的组成为核心(HDAC1、HDAC2、RBAP46öRBAP48)SIN3AöSIN3B、SAP30öSAP18共同构成。
SIN3复合物通过组分SIN3A与序列特异性转录因子或共同抑制物包括mael2max,核激素受体N2CORöSMRT、甲基化CPG粘附蛋白(MECP2、MBD2)相互作用。Mi22NHRD由核心(HDAC1、HDAC2、RBAP46öRBAP48)Mi2、MTA1öMTA2、MBD3组成,其中MBD3含有MBD样序列,与甲基化DNA有低亲和力,分析发现MBD3与甲基化有关的氨基酸被置换,由此推测MBD3与MBD2相互作用而使Mi22NURD与甲基化DNA结合。由此看出,DNA甲基化和组蛋白去乙酰化协同作用共同参与转录阻遏。
在哺乳动物基因组中,组蛋白则可以有很多修饰形式.一个核小体由两个H2A,两个H2B,两个H3,两个H4组成的八聚体和147bp缠绕在外面的DNA组成.组成核小体的组蛋白的核心部分状态大致是均一的,游离在外的N-端则可以受到各种各样的修饰,包括组蛋白末端的乙酰化,甲基化,磷酸化,泛素化等等。
组蛋白被甲基化的位点是赖氨酸和精氨酸.赖氨酸可以分别被一、二、三甲基化,精氨酸只能被一、二甲基化.在组蛋白H3上,共有5个赖氨酸位点可以被甲基化修饰。
一般来说,组蛋白H3K4的甲基化主要聚集在活跃转录的启动子区域。组蛋白H3K9的甲基化同基因的转录抑制及异染色质有关。EZH2可以甲基化H3K27,导致相关基因的沉默,并且与X-Chromosomeinactivation相关。H3K36的甲基化同基因转录激活相关。
医学应用
预测
最新研究结果显示:组蛋白修饰的整体模式可预测低分级前列腺癌的复发风险。该研究第一作者加利福尼亚大学的Siavash K. Kurdistani表示:这种修饰模式最终可作为前列腺或其他类型癌症的预后或诊断指标,也可作为预测何种患者、患者会对一类o组蛋白去乙酰酶抑制剂新药产生反应的指标。Kurdistani解释:某些组蛋白修饰模式会在一定水平上影响基因的表达,但具体机制尚不清楚。
调控
组蛋白修饰与基因表达调控有关已经被广泛的证明了。PierreEtchegary,StevenReppertandcoworkers的研究表明组蛋白修饰,特别是组蛋白乙酰化对于哺乳动物生物钟的调控是非常重要的。
调控生物钟的关键蛋白Clock和Bmal1驱动着三个period基因(Per1,2,3)和两个细胞色素基因(Cry1,2)的表达。这5个基因的转录本覆盖了生物24小时的时间。但奇怪的是Clock/Bmal1对Per启动子的结合相对稳定,而它们对Cry1启动子最强的结合却反应着Cry1表达的最弱。在这篇文章中E发现是染色体结构的修饰来决定Per和Cry基因的转录的。
研究者发现在Per1和Per2的启动子上组蛋白3的乙酰化在全天都存在,而RNA多聚酶Ⅱ也一直被招募在这些启动子上。当H3被乙酰化和RNA多聚酶Ⅱ结合最强时,Per转录本水平最高,这说明H3的乙酰化可能通过促进将RNA多聚酶Ⅱ招募到启动子上而促进基因的转录。Cry基因座位的表达也有类似的相关性。
研究者发现具有蛋白质乙酰化活性的p300在小鼠肝细胞中能与Clock组成复合物。研究者认为白天p300/Bmal1/Clock结合在启动子上,促进H3乙酰化,RNA多聚酶Ⅱ招募到启动子上而Per基因发生转录。夜间p300与Bmal1/Clock进行解离,导致组蛋白的去乙酰化而抑制基因的转录。
那么,导致p300基因日夜节律的是什么呢?
参考资料
[1]
化工引擎:组蛋白;histone[引用日期2011-11-27]
[2]
生命经纬:组蛋白(histone) ,2005-6-21[引用日期2011-11-27]


